题目内容
如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液.

(1)A、B、C三个装置中属于原电池的是
(2)A池中Zn是
(3)B池中C是
(4)C池中Zn是

(1)A、B、C三个装置中属于原电池的是
A
A
(填标号,下同),属于电解池的是BC
BC
.(2)A池中Zn是
负
负
极,发生氧化
氧化
反应(填“氧化”或“还原”,下同),电极反应式为Zn-2e-=Zn2+
Zn-2e-=Zn2+
;Cu是正
正
极,发生还原
还原
反应,电极反应式为Cu2++2e-=Cu
Cu2++2e-=Cu
,A中总反应的化学方程式为Zn+Cu2+=Zn2++Cu
Zn+Cu2+=Zn2++Cu
.(3)B池中C是
阴
阴
极,发生还原
还原
反应,电极反应式为Cu2++2e-=Cu
Cu2++2e-=Cu
;Pt是阳
阳
极,发生氧化
氧化
反应,电极反应式为2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.B池中总反应的化学方程式为CuCl2
Cl2↑+Cu
| ||
CuCl2
Cl2↑+Cu
.
| ||
(4)C池中Zn是
阴
阴
极,发生还原
还原
反应,电极反应式为Cu2++2e-=Cu
Cu2++2e-=Cu
;Cu是阳
阳
极,发生氧化
氧化
反应,电极反应式为Cu-2e-=Cu2+
Cu-2e-=Cu2+
,反应过程中,溶液浓度不变
不变
(填“变大”“变小”或“不变”).分析:(1)把化学能转变为电能的装置是原电池,把电能转化为化学能的装置是电解池,所以电解池有外接电源;
(2)铜、锌、氯化铜原电池中,较活泼的金属作负极,负极上失电子发生氧化反应,较不活泼的金属作正极,正极上得电子发生还原反应,将正负极电极反应式相加即得电池反应式;
(3)该装置是电解池,连接电源负极的是阴极,阴极上得电子发生还原反应,连接电源正极的是阳极,阳极上失电子发生还原反应,将两个电极反应式相加即得电池反应式;
(4)该装置是电解池,阳极上活泼金属,所以阳极上金属失电子发生氧化反应,正极上阴离子得电子发生还原反应,根据阴阳极上的电极反应式确定溶液浓度是否变化.
(2)铜、锌、氯化铜原电池中,较活泼的金属作负极,负极上失电子发生氧化反应,较不活泼的金属作正极,正极上得电子发生还原反应,将正负极电极反应式相加即得电池反应式;
(3)该装置是电解池,连接电源负极的是阴极,阴极上得电子发生还原反应,连接电源正极的是阳极,阳极上失电子发生还原反应,将两个电极反应式相加即得电池反应式;
(4)该装置是电解池,阳极上活泼金属,所以阳极上金属失电子发生氧化反应,正极上阴离子得电子发生还原反应,根据阴阳极上的电极反应式确定溶液浓度是否变化.
解答:解:(1)A没有外接电源,属于原电池,BC装置都有外接电源,所以是把电能转化为化学能的装置,属于电解池,
故答案为:A;BC;
(2)铜、锌、氯化铜原电池中,锌作负极,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,
铜作正极,正极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,所以该原电池的电池反应式为:Zn+Cu2+=Zn2++Cu,
故答案为:负;氧化;Zn-2e-=Zn2+;正;还原;Cu2++2e-=Cu;Zn+Cu2+=Zn2++Cu;
(3)该装置是电解池,且阳极是惰性电极,C连接电源负极,所以是阴极,阴极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,铂连接电源正极,所以铂在阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,所以其电池反应式为:CuCl2
Cl2↑+Cu,
故答案为:阴;还原;Cu2++2e-=Cu;阳;氧化;2Cl--2e-=Cl2↑;CuCl2
Cl2↑+Cu;
(4)该装置是电解池,且阳极是活泼电极,锌是阴极,阴极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,铜是阳极,阳极上铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,阴极上析出的铜恰好等于阳极上溶解的铜,所以溶液中浓度不变,
故答案为:阴;还原;Cu2++2e-=Cu;阳;氧化;Cu-2e-=Cu2+;不变.
故答案为:A;BC;
(2)铜、锌、氯化铜原电池中,锌作负极,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,
铜作正极,正极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,所以该原电池的电池反应式为:Zn+Cu2+=Zn2++Cu,
故答案为:负;氧化;Zn-2e-=Zn2+;正;还原;Cu2++2e-=Cu;Zn+Cu2+=Zn2++Cu;
(3)该装置是电解池,且阳极是惰性电极,C连接电源负极,所以是阴极,阴极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,铂连接电源正极,所以铂在阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,所以其电池反应式为:CuCl2
| ||
故答案为:阴;还原;Cu2++2e-=Cu;阳;氧化;2Cl--2e-=Cl2↑;CuCl2
| ||
(4)该装置是电解池,且阳极是活泼电极,锌是阴极,阴极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,铜是阳极,阳极上铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,阴极上析出的铜恰好等于阳极上溶解的铜,所以溶液中浓度不变,
故答案为:阴;还原;Cu2++2e-=Cu;阳;氧化;Cu-2e-=Cu2+;不变.
点评:本题考查原电池和电解池原理,易错题是(4),注意电解池中,活泼电极作阳极,则阳极上电极材料失电子而不是电解质溶液中阴离子失电子,为易错点.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目


 如图所示,a、b、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是( )
如图所示,a、b、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是( )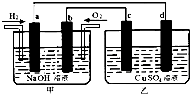 如图所示,a、b、c、d为惰性电极.甲装置中a、b两个电极上分别通入H2、O2,电解质溶液为NaOH溶液,乙装置中电解质溶液为CuSO4溶液,下列有关说法正确的是( )
如图所示,a、b、c、d为惰性电极.甲装置中a、b两个电极上分别通入H2、O2,电解质溶液为NaOH溶液,乙装置中电解质溶液为CuSO4溶液,下列有关说法正确的是( ) 在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则:
在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则: