题目内容
7.结合如图判断,下列叙述正确的是( )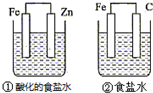
| A. | ①和②中铁的腐蚀均被加速 | |
| B. | ①和②中负极反应均是Fe-2e-═Fe2+ | |
| C. | ②中碳棒上反应是O2+2H2O+4e-═4OH- | |
| D. | ①装置中溶液pH会升高,②装置中溶液碱性增强 |
分析 两个装置都是原电池,①中电解质溶液呈酸性,锌作负极,铁作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,所以该装置中金属发生析氢腐蚀;②中电解质溶液呈中性,铁发生吸氧腐蚀,铁作负极,碳作正极,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应.
解答 解:A.①中铁作正极而被保护,故A错误;
B.①中铁电极上发生的反应为:2H++2e-=H2 ↑,故B错误;
C.②中铁发生吸氧腐蚀,碳棒作正极,碳棒上的反应是O2+2H2O+4e-=4OH-,故C正确;
D.①为锌的析氢腐蚀,pH会增大,②为钢铁的吸氧腐蚀,装置中溶液碱性不变,故D错误;
故选C.
点评 本题考查原电池原理,注意电极反应式的书写、正负极的判断等知识点,为易错点.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
18. 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )| A. | BC段为Fe3+的变化曲线 | |
| B. | 原混合溶液中FeBr2的物质的量为6mol | |
| C. | 当通入2mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
15.类推是在化学学习和研究中常用的思维方法,但类推出的结论最终要经过实践的检验才能决定其正确与否,下列几种类推结论中错误的是( )
| A. | 由Fe跟S直接化合可得FeS,类推出Cu跟S直接化合可得Cu2S | |
| B. | 金属镁失火不能用CO2灭火,金属钠失火也不能用CO2灭火 | |
| C. | NH4Cl、NH4I结构相似,将两种固体分别加热,分解都只生成卤化氢和氨气 | |
| D. | 原电池中通常是活泼金属做负极,不活泼金属做正极,用镁和铝与NaOH溶液构成原电池时,镁是负极 |
2.某炔烃与H2充分加成后的产物为 ,此炔烃可能的结构有( )
,此炔烃可能的结构有( )
 ,此炔烃可能的结构有( )
,此炔烃可能的结构有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
12.将甲苯(C7H8)和甘油(C3H8O3)以一定比例混合,测得混合物含碳51.3%,则氧的质量分数为( )
| A. | 40% | B. | 35% | C. | 30% | D. | 无法计算 |
19.下列有关化学实验的叙述正确的是( )
| A. | 用稀盐酸洗涤盛放过石灰水的试剂瓶 | |
| B. | 配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 | |
| C. | 用待测液润洗滴定用的锥形瓶 | |
| D. | Na2CO3溶液保存在带玻璃塞的试剂瓶中 |
16.乙烷受热分解生成乙烯和氢气,取1体积分解后混合气使其充分燃烧生成1.6体积的二氧化碳气体(在相同条件下测定),则乙烷的分解率为( )
| A. | 20% | B. | 25% | C. | 50% | D. | 75% |
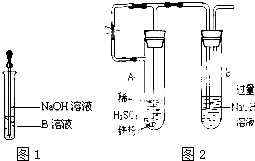 某同学利用右图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.
某同学利用右图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.