题目内容
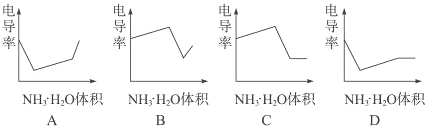
【题目】由等体积、等pH的Ba(OH)2、NaOH、NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3 , 则三者的大小关系正确的是( )
A.V3>V2>V1
B.V3=V2=V1
C.V3>V2=V1
D.V1=V2>V3
【答案】D
【解析】Ba(OH)2、NaOH为强碱,在水溶液中完全电离,等体积、等pH的溶液中,所含n(OH-)相等,由H++OH-===H2O,可知二者消耗同一盐酸的体积相等,即V1=V2;由于NH3·H2O为弱碱,溶液中存在着电离平衡NH3·H2O ![]() OH-+NH4+ , 故与Ba(OH)2、NaOH等pH、等体积的溶液中,n(NH3·H2O)>n(OH-),所以与同一盐酸反应时消耗盐酸的体积大。
OH-+NH4+ , 故与Ba(OH)2、NaOH等pH、等体积的溶液中,n(NH3·H2O)>n(OH-),所以与同一盐酸反应时消耗盐酸的体积大。
【考点精析】利用酸碱中和滴定对题目进行判断即可得到答案,需要熟知中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.

练习册系列答案
相关题目
【题目】用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中选出正确选项( )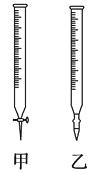
锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
A | 碱 | 酸 | 石蕊 | 乙 |
B | 酸 | 碱 | 酚酞 | 甲 |
C | 碱 | 酸 | 甲基橙 | 乙 |
D | 酸 | 碱 | 酚酞 | 乙 |
A.A
B.B
C.C
D.D