题目内容
【题目】(1)HCl、NH4Cl、CH3COOH和CH3COONa是中学常见的物质。
①常温下在pH=7的CH3COOH和CH3COONa的混合液中c(Na+)_______c(CH3COO-)(填“>”、“<”或“=”);
②常温下pH均为6的HCl和NH4Cl两种溶液中,设由水电离产生的H+浓度分别为amol/L和bmol/L,则a与b的关系是_______;
A.a=b B.a=100b C.b=100a
(2)T℃,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C物质的量变化如图所示。
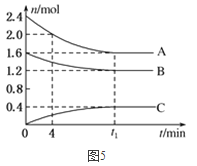
①T℃时,该反应的化学方程式为________;
②0~4分钟时,A的平均反应速率为_______molL-1min-1;
③达到平衡时B的转化率为________;
④T℃时,该反应的平衡常数为________。
(3)将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)ΔH=+140.5kJ/mol
C(s,石墨)+![]() O2(g)=CO(g) ΔH=-110.5kJ/mol
O2(g)=CO(g) ΔH=-110.5kJ/mol
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(l)+2CO(g)的ΔH是_______。
A.+80.5kJ/mol B.+30.0kJ/mol
C.-30.0kJ/mol D.-80.5kJ/mol
(4)Cu(OH)2在水溶液中存在溶解平衡:Cu(OH)2(s)![]() Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)c2(OH-)=2×10-20。当溶液中各离子浓度幂的乘积大于溶度积时,则产生沉淀,反之无沉淀。某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH>________。
Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)c2(OH-)=2×10-20。当溶液中各离子浓度幂的乘积大于溶度积时,则产生沉淀,反之无沉淀。某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH>________。
(5)茫茫黑夜中,航标灯为航海员指明了方向.航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。
①该电池中,海水是电解质溶液,负极材料_______(填“铝合金”或“Pt-Fe合金网”);
②该电池中负极电极反应式为_______。
【答案】= C 2A+B![]() C 0.05 25% 0.52 D 5 铝合金 Al-3e-=Al3+
C 0.05 25% 0.52 D 5 铝合金 Al-3e-=Al3+
【解析】
(1)①根据电荷守恒CH3COOH和CH3COONa的混合液中c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),pH=7的溶液,c(H+)=c(OH-),所以c(Na+)=c(CH3COO-);
②HCl抑制水电离,常温下pH为6的HCl,由水电离产生的H+浓度等于OH-的浓度,由水电离产生的H+浓度等于![]() mol/L;NH4Cl水解促进水电离,常温下pH为6的NH4Cl,由水电离产生的H+浓度等于
mol/L;NH4Cl水解促进水电离,常温下pH为6的NH4Cl,由水电离产生的H+浓度等于![]() mol/L,所以b=100a,选C;
mol/L,所以b=100a,选C;
(2)①A、B的物质的量减少、C的物质的量增加,A、B是反应物、C是生成物,0到t3时刻,A的变化量是0.8mol、B的变化量是0.4mol,C的变化量是0.4mol,变化量比等于系数比,所以反应方程式是2A+B![]() C;
C;
②v(A)=![]() 0.05 mol·L-1·min-1;
0.05 mol·L-1·min-1;
③达到平衡时B的转化率=变化量/初始量×100%=(1.6-1.2)/1.6×100%=25%;
④T℃时,该反应的平衡常数=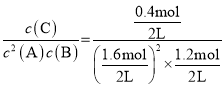 =0.52;
=0.52;
(3)①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)ΔH=+140.5kJ/mol
②C(s,石墨)+![]() O2(g)=CO(g) ΔH=-110.5kJ/mol
O2(g)=CO(g) ΔH=-110.5kJ/mol
根据盖斯定律①+②×2得TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(l)+2CO(g),ΔH=+140.5kJ/mol -110.5kJ/mol×2=-80.5kJ/mol,选D;
(4)c(Cu2+)c2(OH-)>2×10-20时生成沉淀,c(Cu2+)=0.02mol/L,则c2(OH-)>![]() ,c(OH-)>
,c(OH-)>![]() mol/L,所以应调整溶液pH>5;
mol/L,所以应调整溶液pH>5;
(5)原电池中活泼金属作负极,铝的活泼性大于铁,所以负极材料是铝合金;负极Al失电子生成Al3+,电极反应为Al-3e-=Al3+。

 名校课堂系列答案
名校课堂系列答案