题目内容
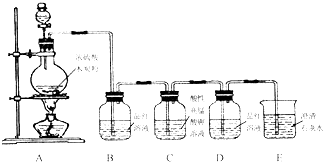
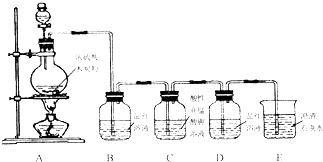
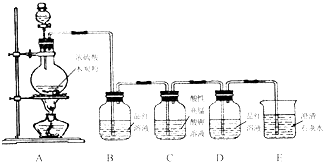
 某同学用如图装置做中和热的测定实验
某同学用如图装置做中和热的测定实验实验步骤:①组装仪器②分别量取50mL 0.50mol/L的盐酸和50mL 0.55mol/L NaOH溶液,记录起始温度t1.③混合反应并准确量取混合液最高温度,记录终止温度.④重复实验三次,取终止温度平均值为t2.⑤计算
回答下列问题:
(1)如图装置缺乏的仪器是:
(2)误差分析:(填偏大偏小无影响)
①未及时测出最高温度,其值
②用环形铜丝代替环形玻璃棒
(3)为什么所用氢氧化钠浓度要比盐酸浓度稍大?
(4)泡沫塑料的作用是:
(5)如果中和后的溶液的比热容为ckJ/(g?℃),假设盐酸和氢氧化钠的密度与水相同且忽略实验装置的比热容,则生成1mol水时的反应热为:△H=
(2)①未及时测出最高温度,测得温度差偏小;
②实验时用环形铜丝搅拌棒代替环形玻璃搅拌棒,散失热量,测得温度差偏小;
(3)根据氢氧化钠足量确保盐酸完全反应,放出的热量更完全;
(4)为减少热量散失,应使小烧杯口与大烧杯口持平,其余部分用泡沫塑料填满;
(5)先根据公式Q=cm△T来求出生成0.025mol的水放出热量,然后根据中和热的概念求出反应热;
故答案为:温度计;
(2)①未及时测出最高温度,测得温度差偏小,由Q=cm△T可知热量偏小,中和热的数值偏小,
故答案为:偏小;
②实验时用环形铜丝搅拌棒代替环形玻璃搅拌棒,散失热量,测得温度差偏小,由Q=cm△T可知热量偏小,中和热的数值偏小,
故答案为:偏小;
(3)根据氢氧化钠足量确保盐酸完全反应,放出的热量更完全,使测得的数值更准确;
故答案为:使盐酸充分反应;
(4)为减少热量散失,应使小烧杯口与大烧杯口持平,其余部分用泡沫塑料填满,所以泡沫塑料的作用防止反应放出的热量散失;
故答案为:防止反应放出的热量散失;
(5)50mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液,溶液质量m=100mL×1g/mL=100g,比热容为ckJ/(g?℃),温度差为t2-t1,代入公式Q=cm△T得生成0.025mol的水放出热量Q=ckJ/(g?℃)×100g×(t2-t1)=100cKJ,所以生成1mol的水放出热量
| 100cKJ |
| 0.025 |
故答案为:-4000ckJ/mol;

(12分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快。
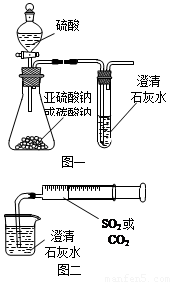
(1)对比分析两组实验,你认为用图一装置实验
时,通入SO2不能出现浑浊的原因可能是:
_________________。
(2)用图二装置实验时,以相同速率通入CO2或
SO2,SO2产生浑浊、澄清的现象比CO2
快的原因是______________________________________。
(3)用图一进行SO2与石灰水反应的实验时,从安全角度
考虑装置应做何改进?
_____________________________________________。
(4)有人提出上述实验现象“石灰水先变浑浊再澄清”可能与澄清石灰水的浓度有关。为了探究CO2通入澄清石灰水中的实验现象,查得下列数据:
Ⅰ 20℃时,Ca(OH)2 的溶解度为:0.165g/100g水。
Ⅱ 不同浓度石灰水生成CaCO3的最大量
|
饱和石灰水与水的体积比 |
1:0 |
1:1 |
1:2 |
1:3 |
1:5 |
1:7 |
|
能生成CaCO3的最大量(g/100水) |
A |
0.110 |
0.073[来源:Zxxk.Com] |
0.055 |
0.037 |
0.028 |
① 上表中A= g/100g水
Ⅲ 在1.01×105Pa CO2压力下,CaCO3的溶解度
|
热力学温度/K |
282 |
298 |
308 |
|
CaCO3溶解度(g/100水)[来源:学#科#网Z#X#X#K] |
0.130 |
0.094 |
0.076 5 |
Ⅳ 在不同压强(CO2)下,CaCO3溶解度(18℃)
|
P(CO2)/Pa |
0 |
1.40×104 |
9.95×104 |
|
CaCO3溶解度(g/100水) |
0.001 3 |
0.023 3 |
0.108 6 |
认真分析以上数据回答下列问题:
②由表Ⅲ和表Ⅳ可知CaCO3溶解度的变化规律是:
③由以上数据可以得出结论:欲观察到“石灰水先变浑浊再澄清的现象”,所需要的实验条件是: