题目内容
4.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0,T1温度下的部分实验数据为
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 其他条件不变,T2温度下反应到1000s时N2O5(g)浓度为2.98mol•L-1,则T1<T2 | |
| B. | T1温度下的平衡常数值为K1=125,1000s时转化率为50% | |
| C. | 500s内N2O5分解速率为2.96×10-3 mol•L-1•s-1 | |
| D. | 该反应△S>0,虽然是吸热反应,在常温下也能自发进行 |
分析 A.该反应正反应是吸热反应,升高温度,反应速率加快,平衡向正反应移动,平衡时时N2O5(g)浓度应降低;
B.由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,计算平衡浓度结合平衡常数概念计算平衡常数,根据转化率=$\frac{浓度变化量}{起始浓度}$×100%计算;
C.依据图标数据分析计算500s内N2O5(g)消耗的浓度计算分解率;
D.根据题中数据可知,该反应△S>0,虽然是吸热反应,在常温下该反应是能自发进行的;
解答 解:A.该反应正反应是吸热反应,升高温度,反应速率加快,平衡向正反应移动,平衡时时N2O5(g)浓度应降低,其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,浓度大于2.5mol/L,故不可能为升高温度,应为降低温度,故T1>T2,故A错误;
B.由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,c(NO2)=5mol/L,c(O2)=1.25mol/L,平衡常数K=$\frac{c(O{\;}_{2})c{\;}^{4}(NO{\;}_{2})}{c{\;}^{2}(N{\;}_{2}O{\;}_{5})}$=$\frac{1.25×5{\;}^{4}}{2.5{\;}^{2}}$=125,转化率为$\frac{5mol/L-2.5mol/L}{5mol/L}$×100%=50%,故B正确;
C.依据图标数据分析计算500s内N2O5(g)消耗的浓度=5.00mol/L-3.52mol/L=1.48mol/L,分解速率=$\frac{1.48mol/L}{500s}$=2.96×10-3 mol/(L•s),故C正确;
D.根据题中数据可知,该反应△S>0,虽然是吸热反应,在常温下该反应是能自发进行的,故D正确;
故选:A.
点评 本题考查化学平衡状态判断、化学平衡有关计算、化学平衡影响因素、平衡常数等,难度中等.

| A. | 金属钠暴露在空气中,表面变暗,生成淡黄色固体 | |
| B. | 用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼的黄光 | |
| C. | 用坩埚钳夹住铝箔在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落 | |
| D. | 钠常常保存在石蜡油或煤油中 |
| A. | 正常雨水的pH值是7 | |
| B. | 冶炼金属钠用热分解法 | |
| C. | 使用过的塑料可以随意丢弃 | |
| D. | 治理水污染可以用混凝法、中和法、沉淀法等 |
| A. | 向NaHSO3溶液中加入NaHSO4溶液:HSO${\;}_{3}^{-}$+H+═H2O+SO2↑ | |
| B. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | Ba(OH)2与H2SO4两稀溶液混合:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
| A. | 催化剂 | B. | 温度 | C. | 浓度 | D. | 压强 |
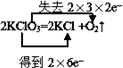 .
.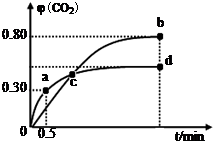 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为: