题目内容
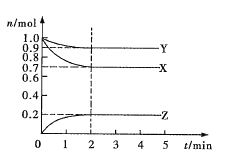
【题目】短周期元素 A、B、C、D 的原子序数依次增大,B 和 D 同主族,A 和 C 同主族;X、Y、N 分别是由以上四种元素中两种组成的化合物,Z 是由以上三种元素组成的化合物;若 X 与 Y 的摩尔质量相同, Y 为淡黄色固体,N 常温下是液体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
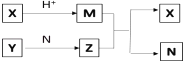
A.相对分子质量M>N,沸点 M>NB.原子半径:D>B>C>A
C.Z 为 NaOHD.M 中含有非极性键
【答案】C
【解析】
由Y为淡黄色固体的化合物可知Y为Na2O2,X与Y的摩尔质量相同可推知X为Na2S,结合原子序数以及B和D同主族、N常温下是液体等可知,A为H,B为O,C为Na,D为S,由此分析可得出结论。
A.N为H2O,M为H2S,相对分子质量M>N,水分子间含氢键,则沸点为N> M,A选项错误;
B.A、B、C、D四种元素的原子半径由元素周律可知钠原子的半径是最大的,B选项错误;
C.根据物质的转化关系,Na2O2与H2O反应生成NaOH和O2,NaOH与H2S反应生成Na2S,可知Z为NaOH,C选项正确;
D.M为H2S,是一种极性分子,含极性键而不含非极性键,D选项错误;
答案选C。

【题目】2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为 。

②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
【题目】在某温度下,向三个初始体积为1L的密闭容器中按表所示投料,发生反应N2(g)+3H2(g)2NH3(g)△H<0,达到平衡时,下列说法错误的是
容器编号 | 容器类型 | 起始物质的量 | 反应物的转化率 | 平时时 | ||
|
|
| ||||
Ⅰ | 恒温恒容 | 1 | 3 | 0 |
|
|
Ⅱ | 绝热恒容 | 0 | 0 | 2 |
| a |
Ⅱ | 恒温恒压 | 1 | 3 | 0 |
| b |
A.平衡时NH3的物质的量:a>1.2,b>1.2
B.容器I、II中平衡常数关系:K(I)>K(II)
C.a1+a2<1
D.若起始时向容器A中充入lmolN2(g)、0.4molH2(g)、0.4molNH3(g),此时平衡向正反应方向移动