题目内容
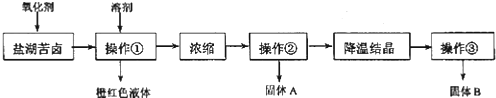
【题目】在某温度下,向三个初始体积为1L的密闭容器中按表所示投料,发生反应N2(g)+3H2(g)2NH3(g)△H<0,达到平衡时,下列说法错误的是
容器编号 | 容器类型 | 起始物质的量 | 反应物的转化率 | 平时时 | ||
|
|
| ||||
Ⅰ | 恒温恒容 | 1 | 3 | 0 |
|
|
Ⅱ | 绝热恒容 | 0 | 0 | 2 |
| a |
Ⅱ | 恒温恒压 | 1 | 3 | 0 |
| b |
A.平衡时NH3的物质的量:a>1.2,b>1.2
B.容器I、II中平衡常数关系:K(I)>K(II)
C.a1+a2<1
D.若起始时向容器A中充入lmolN2(g)、0.4molH2(g)、0.4molNH3(g),此时平衡向正反应方向移动
【答案】D
【解析】
![]() 绝热恒容时,为NH3反应物,发生反应2NH3(g)N2(g)+3H2(g)△H>0,正反应为吸热反应,温度降低,平衡向生成
绝热恒容时,为NH3反应物,发生反应2NH3(g)N2(g)+3H2(g)△H>0,正反应为吸热反应,温度降低,平衡向生成![]() 的方向移动,a>1.2,反应N2(g)+3H2(g)2NH3(g)为气体体积减小的反应,恒温恒压时,与原平衡相比相当于压强增大,平衡向生成NH3的方向移动,
的方向移动,a>1.2,反应N2(g)+3H2(g)2NH3(g)为气体体积减小的反应,恒温恒压时,与原平衡相比相当于压强增大,平衡向生成NH3的方向移动,
b>1.2,故A正确;
B.平衡常数与温度有关,容器Ⅱ绝热,且反应2NH3(g)N2(g)+3H2(g)△H>0,随反应进行,温度会越来越低,且Ⅱ反应为Ⅰ的逆反应,则容器I、II中平衡常数关系:K(I)>K(II),故B正确;
C.根据A分析,NH3的转化率减小,即容器I中N2的转化率与容器Ⅱ中NH3的转化率之和小于1,故C正确;
D.容器I中反应达到平衡状态时,![]() ,
,![]() ,
,![]() ,化学平衡常数
,化学平衡常数![]() ,若起始时向容器A中充入lmolN2(g)、0.4molH2(g)、0.4molNH3(g),浓度商
,若起始时向容器A中充入lmolN2(g)、0.4molH2(g)、0.4molNH3(g),浓度商![]() ,则该反应向逆反应方向移动,故D错误。
,则该反应向逆反应方向移动,故D错误。
答案选D。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】甲醇是一种新型燃料,工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116kJ/mol
CH3OH(g) △H1=-116kJ/mol
(1)已知:CO(g)+![]() O2(g)=CO2 (g) △H2=-283kJ/mol
O2(g)=CO2 (g) △H2=-283kJ/mol
H2(g) +![]() O2(g)=H2O (g) △H1=-242kJ/mol
O2(g)=H2O (g) △H1=-242kJ/mol
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式:________________
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。

请回答:
①在上述三种温度中,曲线Z对应的温度是_________
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)=CH3OH(g)的平衡常数 K=_________。
③下列既能提高上述反应中 CO 的平衡转化率,又能增大反应速率的是____(填标号)。
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
④若上述反应在某恒温恒容容器中发生,能说明该反应达到平衡的是____(填标号)。
a.气体平均相对分子质量保持不变 b.△H1保持不变
c.![]() 保持不变 d.气体密度保持不变
保持不变 d.气体密度保持不变
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol/L)变化如下表所示:
0min | 5min | 10min | |
CO | 0.1 | 0.05 | |
H2 | 0.2 | 0.2 | |
CH3OH | 0 | 0.04 | 0.05 |
若5min~10min只改变了某一条件,所改变的条件是______________。