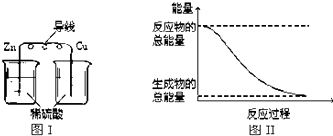
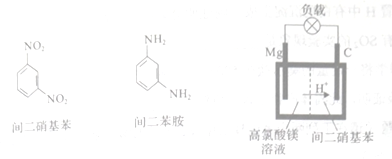
��Ŀ����
����Ŀ��ij�������������NaCl��NaI��NH4Cl��Na2CO3��Na2SO3��Na2SO4�е�һ�ֻ�����ɣ�ȷ��ȡ4.7g�ù��������������ʵ�飨�����Լ����������������������ɱ�״������

����ʵ�����������й�˵������ȷ����
A. ԭ�����������Ƿ���NaC1��ȷ��
B. ԭ���������бغ���NH4Cl��Na2CO3��Na2SO3
C. �ⶨ������ɫ����3������������ȷ�����������
D. ����Һ1��ֻ��BaCl2�������ɰ�ɫ������������С��6.63g
���𰸡�C
��������A. ���ڼ�����Լ�BaCl2����Cl�������Բ���ȷ��ԭ�����������Ƿ���NaC1����A��ȷ��B. �ù����ڼ�������������������Ũ��Һ���ò���������˵��ԭ���������к���NH4Cl����Һ1��BaCl2��H2O2�������ɵİ�ɫ����1�����������ᣬ˵����ɫ����1����̼�ᱵ�����ᱵ��ԭ���������к���Na2CO3����״����448mL���������ʵ�����0.02mol����Ӧ0.02molNH4Cl��������1.07g���ܽ�������ij���̼�ᱵ������Ϊ6.63g-4.66g=1.97g����ӦNa2CO3������Ϊ1.06g����4.66g���ᱵ��ԭ���������е�Na2SO4ת�����ɣ���Na2SO4������Ϊ2.84g�����NH4Cl��Na2CO3��Na2SO4������֮��Ϊ1.07g+1.06g+2.84g=4.97g>4.7g����ˣ�ԭ���������к���Na2SO3��Na2SO3��H2O2����ΪNa2SO4����B��ȷ��C. ����ɫ����3�������Լ�BaCl2ת���ɵ�AgCl����������ɫ����3������������������û��ֱ�ӹ�ϵ����C����ȷ��D. ����Һ1��ֻ��BaCl2������ԭ���������к���Na2SO3�������ɰ�ɫ������������С��6.63g����D��ȷ����ѡC��

 ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�