题目内容
【题目】镁及其合金广泛应用于航空航天、交通、电池等行业。
已知:CaO(s)+3C(s)=CaC2(s)+CO(g) △H= +464 kJ·mol-1
MgO(s)+ CaC2(s)=CaO(s)+ Mg(g)+2C(s) △H =+177.5 kJ·mol-1
(1)镁可以在二氧化碳中燃烧,写出化学反应方程式_____________________。
(2)写出MgO(s)与C(s)生成1 mol CO(g)和气态镁的热化学方程式:________________。
(3) 用电解法制取镁时,若原料氯化镁含有水时,在电解温度下,原料会形成Mg(OH)Cl,并发生电离反应:Mg(OH)Cl=Mg(OH)++Cl-。电解时在阴极表面会产生氧化镁钝化膜,此时阴极的反应式为________________。
(4)镁/间二硝基苯电池工作时镁转变为氢氧化镁,间二硝基苯则转变为间二苯胺。间二硝基苯、间二苯胺的结构简式和镁/间二硝基苯电池的装置如下:
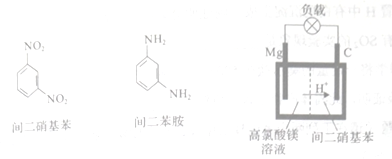
该电池放电时的正极反应方程式为___________________。
【答案】 2Mg+CO2![]() 2MgO + C MgO(s)+C(s)=CO(g)+Mg(g) △H=+641.5 J·mol-1 2Mg(OH)++2e-=2MgO+H2↑
2MgO + C MgO(s)+C(s)=CO(g)+Mg(g) △H=+641.5 J·mol-1 2Mg(OH)++2e-=2MgO+H2↑ 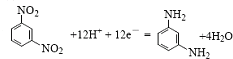
【解析】本题主要考查镁的性质。
(1)镁可以在二氧化碳中燃烧,反应的化学方程式为2Mg+CO2![]() 2MgO + C。
2MgO + C。
(2)将上述两个热化学方程式相加合可得MgO(s)与C(s)生成1 mol CO(g)和气态镁的热化学方程式:MgO(s)+C(s)=CO(g)+Mg(g) △H=+641.5 J·mol-1。
(3) 此时阴极上阳离子 Mg(OH)+被还原,产生氧化镁和氢气,反应式为2Mg(OH)++2e-=2MgO+H2↑。
(4) 该电池放电时的正极反应方程式为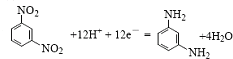 。
。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案