题目内容
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:CO(g)+2H2(g)?CH3OH(g)+Q.
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡.
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是 (填字母).
A.升高温度 B.增大压强 C.通入CO D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡 (填字母).
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)作出此判断的理由是
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的.实验数据见下表:
由上表数据可得出多个结论.
结论一:在一定条件下,反应温度越高,碳转化率 .结论二: .
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡.
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是
A.升高温度 B.增大压强 C.通入CO D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)作出此判断的理由是
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的.实验数据见下表:
| CO2%-CO%-H2% (体积分数) | 0-30-70 | 2-28-70 | 4-26-70 | 8-22-70 | 20-10-70 | |||||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | |
| 碳转化率(%) | CH3OH | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 | 8.0 | 12.0 | 22.6 |
| CH4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2.8 | 2.8 | 2.8 | |
结论一:在一定条件下,反应温度越高,碳转化率
考点:化学平衡的影响因素,化学反应速率的影响因素
专题:化学平衡专题,化学反应速率专题
分析:Ⅰ、(1)提高CO的转化率,可使化学平衡正向移动,加压、减小生成物的浓度、增大氢气的浓度、降温等均能使反应正向移动,以此来解答;
(2)根据影响化学平衡移动的因素来回答;
(3)依据平衡常数分析平衡变化;
Ⅱ、由表格分析得出结论:在一定条件下,反应温度越高,生成甲醇的碳转化率越高;原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高生成甲醇的碳转化率又降低.
(2)根据影响化学平衡移动的因素来回答;
(3)依据平衡常数分析平衡变化;
Ⅱ、由表格分析得出结论:在一定条件下,反应温度越高,生成甲醇的碳转化率越高;原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高生成甲醇的碳转化率又降低.
解答:
解:Ⅰ、(1)A、因该反应为放热反应,则升温平衡逆向移动,CO的转化率降低,故A不选;
B、因该反应为气体体积减小的反应,则加压(缩小体积)化学平衡正向移动,CO的转化率增大,故B选;
C、增大CO的浓度,化学平衡正向移动,但CO的转化率减小,故C不选;
D、增大H2的浓度,化学平衡正向移动,CO的转化率增大,故D选;
故答案为:BD.
(2)保证H2浓度不变的情况下,增大容器的体积,则氮气、氨气的浓度均不变,即Qc仍然是等于K,仍然是平衡状态;
故答案为:C.
(3)反应的平衡常数K
,增大容器体积时,c(CH3OH)和c(CO)等比例减小,由于氢气浓度不变,此时
仍等于K,所以平衡不移动;
故答案为:反应的平衡常数K
,增大容器体积时,c(CH3OH)和c(CO)等比例减小,由于氢气浓度不变,此时
仍等于K,所以平衡不移动;
Ⅱ、由表格中原料气各组分含量不同时反应生成甲醇的碳转化率的数据可知:反应温度越高,生成甲醇的碳转化率越高;二氧化碳的体积分数为2%时生成甲醇的碳转化率最高,二氧化碳的体积分数为20%生成甲醇的碳转化率较低,不含二氧化碳时生成甲醇的碳转化率最低,因此原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高生成甲烷的碳转化率又降低,
故答案为:越高;原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高生成甲烷的碳转化率又降低.
B、因该反应为气体体积减小的反应,则加压(缩小体积)化学平衡正向移动,CO的转化率增大,故B选;
C、增大CO的浓度,化学平衡正向移动,但CO的转化率减小,故C不选;
D、增大H2的浓度,化学平衡正向移动,CO的转化率增大,故D选;
故答案为:BD.
(2)保证H2浓度不变的情况下,增大容器的体积,则氮气、氨气的浓度均不变,即Qc仍然是等于K,仍然是平衡状态;
故答案为:C.
(3)反应的平衡常数K
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
故答案为:反应的平衡常数K
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
Ⅱ、由表格中原料气各组分含量不同时反应生成甲醇的碳转化率的数据可知:反应温度越高,生成甲醇的碳转化率越高;二氧化碳的体积分数为2%时生成甲醇的碳转化率最高,二氧化碳的体积分数为20%生成甲醇的碳转化率较低,不含二氧化碳时生成甲醇的碳转化率最低,因此原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高生成甲烷的碳转化率又降低,
故答案为:越高;原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高生成甲烷的碳转化率又降低.
点评:本题考查学生有关化学平衡的有关知识,可以根据所学知识进行回答,主要是表格中数据的收集、分析、处理能力要求颇高,难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在氧气中灼烧有硫元素和铁元素组成的化合物0.44g,使其中的硫全部转化为二氧化硫,并将二氧化硫,全部氧化成硫酸,这些硫酸与20mL 0.5mol?L-1氢氧化钠溶液恰好完全中和,则原化合物中硫的质量分别约为( )
| A、18% | B、46% |
| C、53% | D、36% |
下列有关电池的说法不正确的是( )
| A、手机上用的锂离子电池属于二次电池 |
| B、铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C、甲醇燃料电池可直接把化学能转化为电能 |
| D、铅蓄电池充电时,阳极的反应为:PbSO4+2H2O-2e-═PbO2+SO42-+4H+ |
常温下,在密闭固定体积容器里分别充入两种气体各0.1mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的
.则原混合气体可能是( )
| 3 |
| 4 |
| A、CO和O2 |
| B、HCl和NH3 |
| C、H2和Cl2 |
| D、H2和O2 |
 .
.
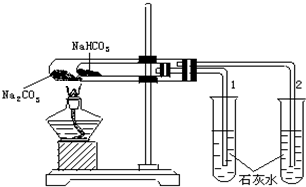 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答: