题目内容
【题目】将3mol/L NaOH溶液滴入到25mL 一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。据图回答:
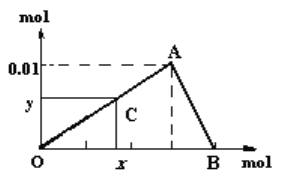
(1)当C点从O点向A点运动时,表示随着OH-的不断加入,沉淀量逐渐________。OA曲线表示的离子反应是:______________________________;由此可得A点的坐标为_______;此时加入氢氧化钠溶液的体积为____________;
(2)AB曲线表示的离子反应为:___________________,由此可得B点的坐标为:_________。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:_____mol/L。
(4)当x=0.035时,铝元素在体系中的存在形式为________,其物质的量为____________。
【答案】 增加 Al3+ + 3OH—=Al(OH)3↓ (0.03,0.01) 10mL Al(OH)3 + OH— =AlO2— + 2H2O (0.04,0) 0.4 Al(OH)3 、AlO2— 0.005mol、 0.005mol
【解析】根据图像,当C点从O点向A点运动时,表示随着OH-的不断加入,沉淀量逐渐增加,A点Al3+刚好完全沉淀,沉淀量达最大值;从A点到B点,随着OH-的不断加入,沉淀量逐渐减少,B点时Al(OH)3刚好完全溶解。根据纵坐标n[Al(OH)3]max=0.01mol和Al守恒,原n(AlCl3)=0.01mol,依据AlCl3物质的量和相关方程式进行计算。
根据图像,当C点从O点向A点运动时,表示随着OH-的不断加入,沉淀量逐渐增加,A点Al3+刚好完全沉淀,沉淀量达最大值;从A点到B点,随着OH-的不断加入,沉淀量逐渐减少,B点时Al(OH)3刚好完全溶解。根据纵坐标n[Al(OH)3]max=0.01mol和Al守恒,原n(AlCl3)=0.01mol。
(1)当C点从O点向A点运动时,表示随着OH-的不断加入,沉淀量逐渐增加,OA曲线表示的离子反应是:Al3++3OH-=Al(OH)3↓,则A点消耗的n(OH-)=3![]() 0.01mol=0.03mol,由此可得A点的坐标为(0.03,0.01)。此时加入NaOH溶液的体积为
0.01mol=0.03mol,由此可得A点的坐标为(0.03,0.01)。此时加入NaOH溶液的体积为![]() =0.01L=10mL。
=0.01L=10mL。
(2)AB曲线表示Al(OH)3溶于NaOH,表示的离子反应为Al(OH)3+OH-=AlO2-+2H2O。溶解0.01molAl(OH)3消耗n(OH-)=0.01mol,则B点的坐标为(0.04,0)。
(3)原n(AlCl3)=0.01mol,c(AlCl3)=![]() =0.4mol/L,AlCl3溶液中Al3+离子的浓度为0.4mol/L。
=0.4mol/L,AlCl3溶液中Al3+离子的浓度为0.4mol/L。
(4)当x=0.035时,加入OH-物质的量大于0.03mol(A点)小于0.04mol(B点),说明AlCl3完全沉淀后并溶解了部分Al(OH)3,铝元素在体系中的存在形式为Al(OH)3和AlO2-。加入0.03molOH-时AlCl3完全沉淀生成0.01molAl(OH)3沉淀,x=0.035mol时,溶解Al(OH)3消耗的n(OH-)为0.035mol-0.03mol=0.005mol,根据离子反应Al(OH)3+OH-=AlO2-+2H2O,0.005molOH-溶解0.005molAl(OH)3同时生成0.005molAlO2-,留下的Al(OH)3为0.01mol-0.005mol=0.005mol;当x=0.035时,铝元素在体系中的存在形式为Al(OH)3和AlO2-,Al(OH)3和AlO2-物质的量都为0.005mol。