题目内容
【题目】实验室制氨气常用以下两种方法:
①用固体氢氧化钙与氯化铵晶体反应制取;
②用固体生石灰与浓氨水混合制取。
请回答下列问题:
(1)写出方法①的化学方程式_______________。
(2)方法②能制取氨气的原理是___________________。
(3)检验氨气是否收集满的方法是______________________。
(4)通常用于证明氨气极易溶于水的实验是______________;氨水显碱性的原因是_____________。
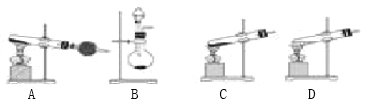
(5)制备氨气的装置如下,方法①应选用_________(填字母,下同),方法②应选用__________。
【答案】Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 生石灰与水反应使溶剂减少,反应放出大量的热,使混合溶液温度升高,利于氨气逸出 在试管口用湿润的红色石蕊试纸检验,看是否变蓝(或在试管口用蘸有浓盐酸的玻璃棒检验,看是否有白烟生成) 喷泉实验(或其他合理方法) NH3+H2O
CaCl2+2NH3↑+2H2O 生石灰与水反应使溶剂减少,反应放出大量的热,使混合溶液温度升高,利于氨气逸出 在试管口用湿润的红色石蕊试纸检验,看是否变蓝(或在试管口用蘸有浓盐酸的玻璃棒检验,看是否有白烟生成) 喷泉实验(或其他合理方法) NH3+H2O ![]() NH3·H2O
NH3·H2O ![]() NH4++OH- A B
NH4++OH- A B
【解析】
(1)制取NH3的反应为加热NH4Cl和Ca(OH)2反应生成氯化钙、氨气和水;
(2)生石灰与水反应放出大量热,溶液温度升高,氨气的溶解度减小,同时反应消耗掉部分水,溶剂减少溶质析出,氨气从溶液中逸出;
(3)氨气是碱性气体,遇到湿润的红色石蕊试纸变蓝色,与浓盐酸挥发出的氯化氢相遇生成白色固体氯化铵,形成白烟;
(4)由于氨气极易溶解于水,所以当使用喷泉装置进行实验时,会形成喷泉;
(5)用固体氢氧化钙与氯化铵共热制备氨气,是固体和固体加热制备气体的反应,在常温下用固体生石灰与浓氨水反应是固体和液体不加热制备气体。
(1)方法①制取NH3的反应为加热NH4Cl和Ca(OH)2反应生成氯化钙、氨气和水,反应的化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)采用方法②制取氨气的原理是生石灰与水反应放出大量热,溶液温度升高,氨气的溶解度减小,氨气从溶液中逸出;同时反应消耗掉部分水,溶剂减少溶质析出,氨气从溶液中逸出,故答案为:生石灰与水反应使溶剂减少,反应放出大量的热,使混合溶液温度升高,利于氨气逸出;
(3)氨气是碱性气体,检验氨气是否收集满的方法是用湿润的红色石蕊试纸靠近集气瓶口,如果试纸变蓝,则证明是氨气收集满,或氨气与浓盐酸挥发出的氯化氢相遇生成白色固体氯化铵,形成白烟,故答案为:在试管口用湿润的红色石蕊试纸检验,看是否变蓝(或在试管口用蘸有浓盐酸的玻璃棒检验,看是否有白烟生成);
(4)由于氨气极易溶解于水,所以当使用喷泉装置进行实验时,会形成喷泉,氨气溶解于得到的是氨水,氨水显碱性,原因是:NH3+H2O ![]() NH3·H2O
NH3·H2O ![]() NH4++OH-,故答案为:喷泉实验;NH3+H2O
NH4++OH-,故答案为:喷泉实验;NH3+H2O ![]() NH3·H2O
NH3·H2O ![]() NH4++OH-;
NH4++OH-;
(5)用固体氢氧化钙与氯化铵共热制备氨气,是固体和固体加热制备气体的反应,应选择A装置,在常温下用固体氢氧化钠与浓氨水反应是固体和液体不加热制备气体,应选择B装置,故答案为:A;B。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案