题目内容
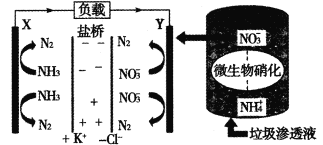
【题目】T℃时,在20.00 mL 0.10 mol/LCH3COOH溶液中滴入0.10 mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。下列说法正确的是
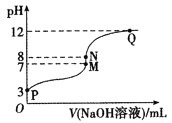
A.T℃时,CH3COOH的电离平衡常数Ka=1.0×10-3
B.M点对应的NaOH溶液的体积为20.00 mL
C.N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.N点与Q点所示溶液中水的电离程度:N>Q
【答案】D
【解析】
A. T℃时,0.10 mol/L CH3COOH溶液的pH=3,说明溶液中c(H+)=10-3 mol/L,则该温度下CH3COOH的电离平衡常数Ka=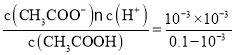 ≈10-5,A错误;
≈10-5,A错误;
B. M点溶液pH=7,若对应的NaOH溶液的体积为20.00 mL,则醋酸与NaOH恰好中和,溶液为CH3COONa,该盐是强碱弱酸盐,水解使溶液显碱性,与题干的溶液显中性相违背,说明M点对应的NaOH溶液的体积小于20.00 mL,B错误;
C. N点时所示溶液中醋酸与NaOH恰好中和,溶液为CH3COONa溶液,CH3COO-发生水解反应而消耗,所以c(Na+)>c(CH3COO-),CH3COO-发生水解反应消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)> c(H+),但盐水解程度是微弱的,水解产生的离子浓度远小于盐电离产生的离子浓度,因此c(CH3COO-)>c(OH-),故该溶液中离子浓度关系为:c(Na+)> c(CH3COO-)>c(OH-)>c(H+),C错误;
D. N点时所示溶液中醋酸与NaOH恰好中和,溶液中的溶质为CH3COONa,溶液中只有盐的水解作用,促进水的电离;而Q点时NaOH过量,溶液为CH3COONa和NaOH的混合液,由于NaOH电离产生OH-对水的电离平衡起抑制作用,使盐水解程度减小,故最终达到平衡时水的电离程度N>Q,D正确;
故合理选项是D。

【题目】已知25℃、101 kPa时某些物质的燃烧热数据如下:
名称 | 化学式 | ΔH (kJ/mol) | 名称 | 化学式 | ΔH (kJ/mol) |
石墨 | C(s) | 393.5 | 乙烷 | C2H6(g) | 1560 |
金刚石 | C(s) | 395.0 | 乙烯 | C2H4(g) | 1411 |
氢气 | H2(g) | 285.8 | 乙炔 | C2H2(g) | 1300 |
一氧化碳 | CO(g) | 283.0 | 乙醇 | C2H5OH(l) | 1367 |
(1)相同质量的上述八种物质,完全燃烧放热最多的名称是____。
(2)石墨与金刚石互为____。
a.同位素 b.同素异形体 c.同分异构体 d.同系物
常温常压下,二者更稳定的是___。(填中文名称)
(3)在标准状况下,22.4LCO和C2H2的混合气体在过量的氧气中完全燃烧放出1096.6 kJ的热,则燃烧产生的CO2的物质的量为___mol。
(4)估算在Ni作催化剂时,乙烯与氢气发生加成反应的焓变。C2H4(g)+H2(g)=C2H6(g) ΔH=____。
(5)已知破坏下列化学键需要吸收的能量如下:
C-C | C=C | H-H |
347kJ/mol | 619kJ/mol | 436kJ/mol |
根据(4)的结论,估算C-H键的键能为____kJ/mol。
a.322.5 b.422.5 c.522.5 d.622.5