题目内容
现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略溶液体积变化)
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为 ,所得溶液中的溶质物质的量浓度为 mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液溶质物质的量浓度为 mol·L-1。
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为 ,所得溶液中的溶质物质的量浓度为 mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液溶质物质的量浓度为 mol·L-1。
①2H++ SO42—+ Ba2+ + 2OH—=BaSO4↓+2H2O 0.067 ②100; 0.1
试题分析:n(H+)="0.1×0.1×2=0.02(" mol),n(SO42-)="0.1×0.1" +0.1×0.1 ="0.02(" mol);n(Ba2+)="0.2×0.05=0.01(" mol),n (OH-)="0.2×0.05×2=0.02(" mol),所以反应实质是H2SO4和Ba(OH)2溶液反应。离子方程式是:2H++ SO42—+ Ba2+ + 2OH—=Ba SO4 ↓+2 H2O。反应后的溶液为Na2SO4溶液其浓度为:C(Na2SO4)=n∕V=0.1×0.1mol∕0.15L=0.067mol∕L.当SO42—+完全反应时沉淀达到最大值,这时n(SO42-)=n(Ba2+)="0.02" mol,V(Ba(OH)2)=0.02mol÷0.2 mol∕L=0.1L=100ml.此时溶液为NaOH溶液,n(NaOH)=n(Na+)=0.1×0.1×2="0.02(" mol),C(NaOH)= =n∕V=0.02mol∕0.2L=0.1mol∕L

练习册系列答案
相关题目



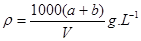
 Fe2(SO4)3+3SO2↑+6H2O]
Fe2(SO4)3+3SO2↑+6H2O]

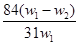
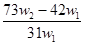

 溶液,应称量
溶液,应称量