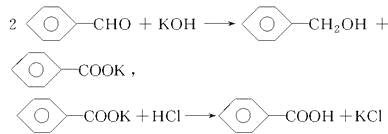
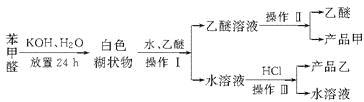
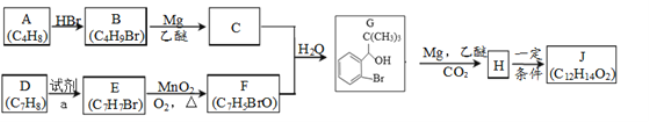
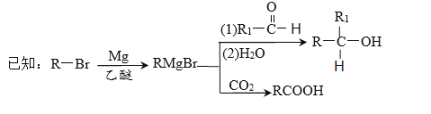
题目内容
【题目】下图为利用海水制备部分物质的过程。下列有关说法正确的是
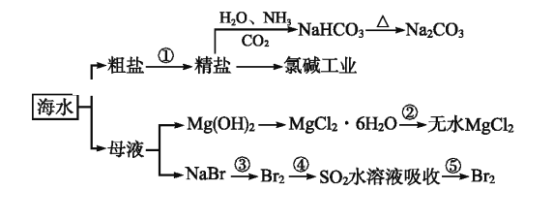
A. 制取NaHCO3的反应是利用其溶解度小于NaCl的溶解度
B. 用澄清的石灰水可鉴别NaHCO3溶液和Na2CO3溶液
C. 在第③、④、⑤步骤中,溴元素均被氧化
D. 加热MgCl2溶液制取无水氯化镁
【答案】A
【解析】
A.往精盐溶液中通氨气,得碳酸氢钠沉淀,说明碳酸氢钠的溶解度小于氯化钠,故A正确;B.分别向碳酸钠和碳酸氢钠溶液中加入澄清石灰水,发生Na2CO3+Ca(OH)2=2NaOH+CaCO3↓、2NaHCO3+Ca(OH)2=Na2CO3+CaCO3↓+2H2O,均有白色沉淀产生,现象相同,不能鉴别,故B错误;C.在步骤③、④、⑤中,第④步中,SO2+2H2O+Br2=H2SO4+2HBr中S元素的化合价升高,则二氧化硫被氧化,溴元素被还原,故C错误;D.加热饱和MgCl2溶液,水解生成的氯化氢易挥发,只能得到氢氧化镁沉淀,需要在氯化氢气氛中加热才能得到无水氯化镁,故D错误;故选A。

 考前必练系列答案
考前必练系列答案【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
A.HCl溶液 | B.H2SO4溶液 | C.氨水 | D.NaOH溶液 |
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。