题目内容
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是___,基态D原子价电子的轨道表达式为___,DA2分子的VSEPR模型是___。
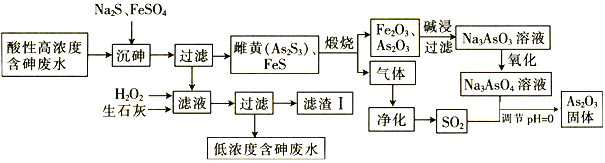
(2)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图1所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于___晶体(填晶体类型),其中C原子的杂化轨道类型为___杂化。
②[C(OH)4]-中存在的化学键有___。
③C2Cl6与过量的NaOH溶液反应的化学方程式为___。
(3)B、C的氟化物晶格能分别是2957kJmol-1、5492kJmol-1,二者相差很大的原因是___。
(4)D与E所形成化合物晶体的晶胞如图2所示。
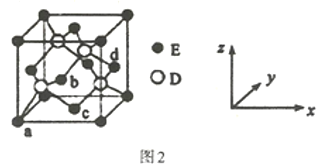
①在该晶胞中,E的配位数为___。
②已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为___pm(列出计算式即可)。
【答案】镁(或Mg) ![]() 平面三角形 分子 sp3 极性共价键、配位键(或共价键、配位键) Al2Cl6+2NaOH+6H2O=2Na[Al(OH)4]+6HCl Al3+比Mg2+电荷高、半径小,AlF3的晶格能比MgF2大得多 4
平面三角形 分子 sp3 极性共价键、配位键(或共价键、配位键) Al2Cl6+2NaOH+6H2O=2Na[Al(OH)4]+6HCl Al3+比Mg2+电荷高、半径小,AlF3的晶格能比MgF2大得多 4 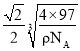 ×1010
×1010
【解析】
由A、D同主族且有两种常见化合物![]() 和
和![]() ,可推出A为O,D为S;由工业上电解熔融
,可推出A为O,D为S;由工业上电解熔融![]() 制取单质C,可推出C为Al;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区,且A、B、C、D、E五种元素原子序数依次增大,可推出B为Mg,E为Zn。
制取单质C,可推出C为Al;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区,且A、B、C、D、E五种元素原子序数依次增大,可推出B为Mg,E为Zn。
(1)根据上述分析,B为Mg元素,C为Al元素,镁的最外层s轨道上有2个电子,处于全充满状态,比相邻元素的第一电离能大,则Mg、Al中第一电离能较大的是Mg;D为S元素,基态原子核外电子排布式为![]() ,则基态D原子价电子的轨道表达式为
,则基态D原子价电子的轨道表达式为![]() ;
;
![]() 为
为![]() ,根据价层电子对互斥理论可知,
,根据价层电子对互斥理论可知,![]() 中硫原子含有的孤电子对数是
中硫原子含有的孤电子对数是![]() ,成键电子对数为2,采用
,成键电子对数为2,采用![]() 杂化,则
杂化,则![]() 分子的VSEPR模型是平面三角形;
分子的VSEPR模型是平面三角形;
(2)![]() 是
是![]() ,根据题意,
,根据题意,![]() 在加热时易升华,说明该分子的熔沸点较低,则
在加热时易升华,说明该分子的熔沸点较低,则![]() 属于分子晶体;根据图给球棍模型可知,Al原子形成4个共价单键,则Al原子的杂化轨道类型为
属于分子晶体;根据图给球棍模型可知,Al原子形成4个共价单键,则Al原子的杂化轨道类型为![]() 杂化;
杂化;
![]() 中Al最外层有3个电子,与O原子形成三个极性共价键,Al原子还有一个空轨道,与氧原子的孤对电子形成配位键,所以
中Al最外层有3个电子,与O原子形成三个极性共价键,Al原子还有一个空轨道,与氧原子的孤对电子形成配位键,所以![]() 中存在的化学键有极性共价键和配位键;
中存在的化学键有极性共价键和配位键;
![]() 与过量的NaOH溶液反应生成偏铝酸钠,化学方程式为
与过量的NaOH溶液反应生成偏铝酸钠,化学方程式为![]() ;
;
(3)B、C的氟化物分别为![]() 、
、![]() ,因为
,因为![]() 比
比![]() 电荷高、半径小,所以
电荷高、半径小,所以![]() 的晶格能比
的晶格能比![]() 大得多。
大得多。
(4)![]() 根据如图所示晶胞,E原子位于顶点和面心,面心上的E原子,与它等距离最近的D原子有4个,则在该晶胞中,E的配位数为4。
根据如图所示晶胞,E原子位于顶点和面心,面心上的E原子,与它等距离最近的D原子有4个,则在该晶胞中,E的配位数为4。
![]() 根据如图所示晶胞,晶胞中有E原子
根据如图所示晶胞,晶胞中有E原子![]() ,D原子位于四分之一晶胞中的4个小正方体的体心上,一共有4个,设该晶胞的边长为xcm,已知该晶胞的密度为
,D原子位于四分之一晶胞中的4个小正方体的体心上,一共有4个,设该晶胞的边长为xcm,已知该晶胞的密度为![]() ,则晶胞的边长
,则晶胞的边长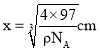 ,其观察晶胞图可知:4个Zn原子分布于8个
,其观察晶胞图可知:4个Zn原子分布于8个![]() 晶胞的中心,并且这4个Zn原子呈正四面体结构,所以2个Zn原子的距离为面对角线的一半,即为
晶胞的中心,并且这4个Zn原子呈正四面体结构,所以2个Zn原子的距离为面对角线的一半,即为 。
。