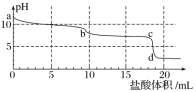
题目内容
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
①该反应中的氧化剂是_____,还原剂是____,每生成1molNa2FeO4转移_______mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用:_________。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。写出并配平湿法制备高铁酸钾的离子反应方程式:______________。
【答案】Na2O2 FeSO4、Na2O2 5 高铁酸钾具有强氧化性,能杀菌消毒,且消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体,能吸附水中悬浮杂质而沉降 2Fe(OH)3+3ClO-+4OH-=2FeO42—+3Cl-+5H2O
【解析】
(1)①氧化剂中元素得电子化合价降低,还原剂中元素失去电子化合价升高,根据氧化还原反应的规律找出电子转移数;
②K2FeO4中Fe元素的化合价为+6价,具有强氧化性,且在溶液中会生成胶体,具有吸附性,据此分析作答;
(2)根据氧化还原反应的配平原则进行配平。
(1)①2FeSO4+6Na2O2=2NaFeO4+2Na2O+2Na2SO4+O2↑中Fe元素的化合价升高,过氧化钠中O元素的化合价既升高又降低,则氧化剂为Na2O2,还原剂为FeSO4和Na2O2,由反应方程式可知,2NaFeO4![]() 10e-,故每生成1molNa2FeO4转移的电子数为
10e-,故每生成1molNa2FeO4转移的电子数为![]() =5mol,故答案为:Na2O2;FeSO4、Na2O2;5;
=5mol,故答案为:Na2O2;FeSO4、Na2O2;5;
②K2FeO4中Fe元素的化合价为+6价,具有强氧化性,且还原产物铁离子能水解生成氢氧化铁胶体,胶体具有吸附性能吸附除去水中的悬浮杂质,本题答案为:高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解成Fe(OH)3胶体能吸附水中悬浮杂质而沉淀;
(2)湿法制备高铁酸钾(K2FeO4),结合物质的性质可知,氢氧化铁被氧化,该离子反应为2Fe(OH)3+3ClO-+4OH-=2FeO42—+3Cl-+5H2O。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案