题目内容
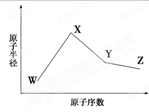
已知:X、Y、Z、W为短周期元素,原子半径X:99pm Y: 154pm Z:125pm W: 117pm,X Y W位置如图所示(副族省略),X、Y、Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是
A、元素Z处于周期表的阴影位置
B、非金属性:X>W
C、X与W形成化合物熔点很高,为离子化合物
D、Y、W的最高价氧化物对应的水化物能反应
| | | | | X |
| Y | | | W | |
A、元素Z处于周期表的阴影位置
B、非金属性:X>W
C、X与W形成化合物熔点很高,为离子化合物
D、Y、W的最高价氧化物对应的水化物能反应
BD
试题分析:根据题意,四元素处在周期表的2、3周期,根据四元素原子的半径可知,Z处于Y、W之间的某一位置上,X、Y、Z的最高价氧化物对应的水化物相互能反应,根据三者在周期表中的相对位置,可以大胆假设Y、Z为金属元素Na、Al,X为非金属元素N;三者的最高价氧化物的水化物分别为NaOH、Al(OH)3、HNO3,恰好能相互反应,所以利用此结论解题。A项假设Z元素处在图中阴影部分,则X、Y、Z的最高价氧化物对应的水化物不能相互反应,A错误;X比W更靠近周期表右上角,根据元素周期律可得,非金属性X>W,B正确;根据推测X、W分别为N、Si元素,二者形成氮化硅属于共价化合物,C错误;D项NaOH和H2SiO3能相互反应正确;故选BD。

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目