题目内容
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
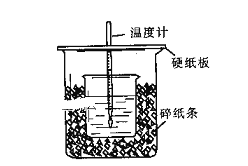
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:______________。
(2)烧杯间填满碎纸条的作用是:_____________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大、偏小、无影响”)
(4)加入NaOH溶液的正确操作是_____________(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(5)上述实验测得的结果与书上的57.3kJ/mol有偏差,产生偏差的原因可能是______________
a.实验装置保温、隔热效果差
b.NaOH溶液倒入盛有硫酸的小烧杯中后未及时将盖板盖好.
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量_______(填“小于”、“等于”或“大于”)57.3kJ
(7)已知:CH3COOH(aq)与NaOH(aq)反应的△H=﹣12.1kJmol﹣1;HCl(aq)与NaOH(aq)反应的△H=﹣55.6kJmol﹣1.则CH3COOH在水溶液中电离的△H等于______________.
A.﹣67.7kJmol﹣1 B.﹣43.5kJmol﹣1 C.+43.5kJmol﹣1 D.+67.7kJmol﹣1
【答案】环形玻璃搅拌棒 保温,防止热散失 偏小 B abc 大于 C
【解析】
(1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失,影响测定结果;
(5)a.装置保温、隔热效果差,测得的热量偏小;
b.将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失;
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液温度,H2SO4的起始温度偏高;
(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:保温,防止热散失;
(3))大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小;
(4)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果;
故答案为:B;
(5)a.装置保温、隔热效果差,测得的热量偏小,则测定的中和热的数值偏小,故a正确;
b.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,分多次把NaOH溶液倒入盛有硫酸的小烧杯中,会导致热量散失较多,则测定的中和热的数值偏小,故b正确;
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液温度,H2SO4的起始温度偏高,温度差偏小,中和热的数值偏小,故c正确;
故选:abc;
(6)浓硫酸稀释放热,反应后的温度偏高,温度差偏大,所测得中和热的数值偏大,故答案为:大于;
(7)根据题意可得如下热化学方程式:CH3COOH (aq) + OH-(aq)= CH3COO-(aq) + H2O(l) ΔH=-12.1 kJ·mol-1,H+(aq) + OH-(aq)=H2O(l) ΔH=-55.6 kJ·mol-1,依据盖斯定律上面第一个式子减第二个式子,得到:CH3COOH (aq)H+(aq )+ CH3COO-(aq) ΔH=(-12.1 kJ·mol-1)-(-55.6 kJ·mol-1)=+43.5 kJ·mol-1综上所述,故选:C。