题目内容
已知:A、B、C、D、E、F 在常温下均为气体,它们有以下转化关系(部分反应条件、产物已略去)

请回答下列问题:
(1)将A 点燃后伸人到装有E 的集气瓶中,可观察到的现象是
(2)C 的浓溶液与黑色粉末反应生成E 的化学方程式为
(3)若将溶液II 滴人到碘化钾溶液中,发生反应的离子方程式为:
(4)向反应后的溶液中加人适量CCl4,充分振荡后静置,可以观察到的现象是:
(5)与溶液I 比较,溶液II中多出的物质是

请回答下列问题:
(1)将A 点燃后伸人到装有E 的集气瓶中,可观察到的现象是
继续燃烧,产生苍白色火焰
继续燃烧,产生苍白色火焰
.(2)C 的浓溶液与黑色粉末反应生成E 的化学方程式为
4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
| ||
4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
.
| ||
(3)若将溶液II 滴人到碘化钾溶液中,发生反应的离子方程式为:
2I-+Cl2═2Cl-+I2
2I-+Cl2═2Cl-+I2
.(4)向反应后的溶液中加人适量CCl4,充分振荡后静置,可以观察到的现象是:
溶液分层,CCl4层在下层呈紫色,上层近乎无色
溶液分层,CCl4层在下层呈紫色,上层近乎无色
.(5)与溶液I 比较,溶液II中多出的物质是
Cl2、HClO
Cl2、HClO
(填化学式).分析:炭与水在高温下生成CO与H2,B与气体F生成气体D,D与淡黄色粉末反应生成F,应是CO2与Na2O2反应生成碳酸钠与氧气,可推知B为CO,F为O2,D为CO2,故A为H2.气体E与水反应,光照可得氧气,可推知E为Cl2,溶液Ⅱ为氯水,结合转化关系可知,C为HCl,溶于水得溶液Ⅰ为盐酸,盐酸与黑色粉末二氧化锰反应可得氯气,符合转化关系,据此解答.
解答:解:炭与水在高温下生成CO与H2,B与气体F生成气体D,D与淡黄色粉末反应生成F,应是CO2与Na2O2反应生成碳酸钠与氧气,可推知B为CO,F为O2,D为CO2,故A为H2.气体E与水反应,光照可得氧气,可推知E为Cl2,溶液Ⅱ为氯水,结合转化关系可知,C为HCl,溶于水得溶液Ⅰ为盐酸,浓盐酸与黑色粉末二氧化锰反应可得氯气,符合转化关系,
(1)将氢气点燃后伸人到装有氯气的集气瓶中,氢气在氯气中继续燃烧,产生苍白色火焰,
故答案为:继续燃烧,产生苍白色火焰;
(2)浓盐酸与黑色粉末二氧化锰反应生成氯化镁、氯气与水,反应方程式为:4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O,
故答案为:4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O;
(3)若将氯水滴入到碘化钾溶液中,氯气氧化碘离子生成碘单质,自身被还有为氯离子,反应离子方程式为:2I-+Cl2═2Cl-+I2,
故答案为:2I-+Cl2═2Cl-+I2;
(4)向反应后的溶液中加人适量CCl4,充分振荡后静置,萃取溶液中的碘,CCl4密度比水大,所以会看到:溶液分层,CCl4层在下层呈紫色,上层近乎无色,
故答案为:溶液分层,CCl4层在下层呈紫色,上层近乎无色;
(5)与溶液I为盐酸含有:H2O、H+、Cl-,溶液Ⅱ为氯水,含有H2O、Cl2、HClO、H+、Cl-,溶液II中多出的物质是Cl2、HClO,
故答案为:Cl2、HClO.
(1)将氢气点燃后伸人到装有氯气的集气瓶中,氢气在氯气中继续燃烧,产生苍白色火焰,
故答案为:继续燃烧,产生苍白色火焰;
(2)浓盐酸与黑色粉末二氧化锰反应生成氯化镁、氯气与水,反应方程式为:4HCl(浓)+MnO2
| ||
故答案为:4HCl(浓)+MnO2
| ||
(3)若将氯水滴入到碘化钾溶液中,氯气氧化碘离子生成碘单质,自身被还有为氯离子,反应离子方程式为:2I-+Cl2═2Cl-+I2,
故答案为:2I-+Cl2═2Cl-+I2;
(4)向反应后的溶液中加人适量CCl4,充分振荡后静置,萃取溶液中的碘,CCl4密度比水大,所以会看到:溶液分层,CCl4层在下层呈紫色,上层近乎无色,
故答案为:溶液分层,CCl4层在下层呈紫色,上层近乎无色;
(5)与溶液I为盐酸含有:H2O、H+、Cl-,溶液Ⅱ为氯水,含有H2O、Cl2、HClO、H+、Cl-,溶液II中多出的物质是Cl2、HClO,
故答案为:Cl2、HClO.
点评:本题考查无机物推断,侧重C、Cl、Na元素化合物转化关系考查,比较基础,注意基础知识的掌握.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
 (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质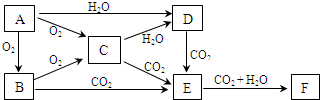
 已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
 已知单质A、B、C、D有如下的反应关系.其中A 在B中燃烧时,火焰呈苍白色; C在B中燃烧时生成棕黄色的烟,E的水溶液呈蓝绿色,G是一种黑色固体.
已知单质A、B、C、D有如下的反应关系.其中A 在B中燃烧时,火焰呈苍白色; C在B中燃烧时生成棕黄色的烟,E的水溶液呈蓝绿色,G是一种黑色固体.