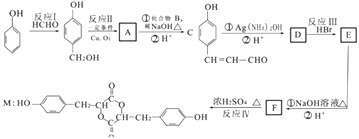
��Ŀ����
����Ŀ����֪�ⶨ�к��ȵ�ʵ�鲽�����£�
����ȡ50mL 0.25mol/L���ᵹ��С�ձ��У������¶ȣ�
����ȡ50mL 0.55mol/L NaOH��Һ�������¶ȣ�
�۽�NaOH��Һ����С�ձ��У���Ͼ��Ⱥ�������Һ�¶ȣ�
��ش�
��1��NaOH��Һ�Թ�����ԭ�� ��
��2������NaOH��Һ����ȷ������__________������ĸ����
A.�ز�������������
B.һ��Ѹ�ټ���
C.�������
��3��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������ ��
��4������Һ���ܶȾ�Ϊ1gcm��3 �� �кͺ���Һ�ı�����c=4.18J��g�棩��1 �� �����ʵ����������к���Ϊ ��д���÷�Ӧ���Ȼ�ѧ����ʽ ��
�¶� | ��ʼ�¶�t1/�� | ��ֹ�¶� | �¶Ȳ�ƽ��ֵ | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
��5��������0.5mol H2SO4��Ũ�����뺬1mol NaOH����Һ��ϣ��ų����������С�ڡ��������ڡ����ڡ���57.3kJ��ԭ���� ��
���𰸡�
��1��ȷ�����ᱻ��ȫ�к�
��2��B
��3���������¶ȼ��ϵĻ��β������������ؽ���
��4��56.85kJ/mol��H2SO4��aq��+2NaOH��aq��=Na2SO4��aq��+2H2O��H=��113.7kJ/mol
��5�����ڣ�Ũ��������ˮ�ų�����
����������1��ʵ���У�����NaOH�Թ�����ԭ����ȷ�����ᷴӦ��ȫ����2����������������Һʱ������һ��Ѹ�ٵĵ��룬Ŀ���Ǽ���������ɢʧ�����ּܷ��ε�������������Һ������ᵼ������ɢʧ��Ӱ��ⶨ����� ��3��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ���������ǣ��������¶ȼ��ϵĻ��β������������ؽ�������4��50mL 0.25mol/L������50mL 0.55mol/L NaOH��Һ�����кͷ�Ӧ����ˮ�����ʵ���Ϊ0.05L��0.25mol/L��2=0.025mol����Һ������Ϊ100ml��1g/ml=100g���¶ȱ仯��ֵΪ����ʵ���ƽ��ֵ3.4�棬������0.025molˮ�ų�������ΪQ=mc��T=100g��4.18J/��g�棩��3.4��=1421.2J����1.421kJ��
����ʵ���õ��к��ȡ�H=��![]() =��56.85kJ/mol���÷�Ӧ���Ȼ�ѧ����ʽH2SO4��aq��+2NaOH��aq��=Na2SO4��aq��+2H2O��H=��113.7kJ/mol����5��Ũ��������ˮ�ų����������Ժ�0.5mol H2SO4��Ũ�����뺬1mol NaOH����Һ��ϣ��ų�����������57.3kJ��
=��56.85kJ/mol���÷�Ӧ���Ȼ�ѧ����ʽH2SO4��aq��+2NaOH��aq��=Na2SO4��aq��+2H2O��H=��113.7kJ/mol����5��Ũ��������ˮ�ų����������Ժ�0.5mol H2SO4��Ũ�����뺬1mol NaOH����Һ��ϣ��ų�����������57.3kJ��
�����㾫����������Ĺؼ����������к��ȵ����֪ʶ��������ϡ��Һ�У���ͼ���кͷ�Ӧ������1mol H2O����ʱ�ķ�Ӧ�Ƚ����к��ȣ�