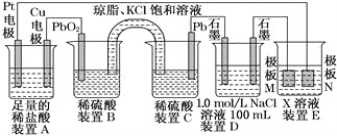
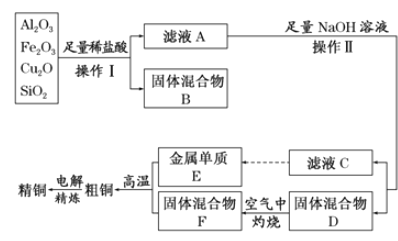
题目内容
【题目】
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、二氧化碳、青霉素、硝酸钾、乙醇、氨等“分子”改变过人类的世界。
(1)铁原子在基态时,外围电子排布式为__________________________。
(2)1 mol CO2分子中含有σ键的物质的量为_________________________。
(3)6-氨基青霉烷酸的结构如图所示:
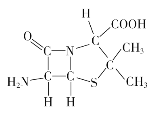
①其中C、N、O电负性由小至大的顺序是_________________。
②其中碳原子的杂化类型是______________。
(4)硝酸钾中![]() 的空间构型为___________,写出
的空间构型为___________,写出![]() 的一种等电子体的化学式______________。
的一种等电子体的化学式______________。
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是_____________。
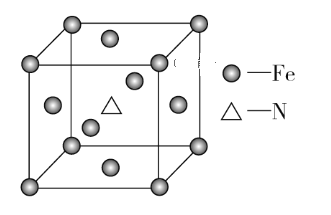
(6)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,该晶体的化学式为____________,若两个最近的Fe原子间的距离为a cm,则该晶体的密度为_________g·cm-3。(用NA表示阿伏加德罗常数的值)
【答案】3d64s2 2 mol C<N<O SP3、SP2 平面三角形 BF3(其他合理答案均可) 乙醇分子间存在氢键,氯乙烷分子间不能形成氢键,所以乙醇的沸点比氯乙烷高。 Fe4N  或
或![]()
【解析】
(1)铁是26号元素,铁原子在基态时的电子排布式是1s22s22p63s23p63d64s2;
(2)CO2分子的结构式是O=C=O;
(3)①同周期元素从左到右电负性增大;
②单键碳原子的杂化轨道数是4、双键碳原子的杂化轨道数是3;
(4)硝酸根中N原子的杂化轨道数是![]() ,无孤电子对; 等电子体是原子数相同、价电子数也相同的分子或离子;
,无孤电子对; 等电子体是原子数相同、价电子数也相同的分子或离子;
(5)乙醇分子间存在氢键;
(6)根据均摊原则计算化学式;根据晶胞图,两个最近的Fe原子间的距离为a cm,则晶胞的面对角线为2acm,晶胞边长是![]() 。
。
(1)铁是26号元素,铁原子在基态时的电子排布式是1s22s22p63s23p63d64s2,外围电子(价电子)排布式为3d64s2;
(2)单键全是σ键、双键中有1个σ键和1个π键, CO2分子的结构式是O=C=O,所以1 mol CO2分子中含有σ键的物质的量为2 mol;
(3)①同周期元素从左到右电负性增大,所以C、N、O电负性由小至大的顺序是C<N<O;
②单键碳原子的杂化轨道数是4、双键碳原子的杂化轨道数是3,6-氨基青霉烷酸中既有单键碳又有双键碳,所以碳原子的的杂化类型是sp3、sp2;
(4)硝酸根中N原子的杂化轨道数是![]() ,无孤电子对,所以硝酸根的空间构型为平面三角形;等电子体是原子数相同、价电子数也相同的分子或离子,硝酸根的价电子数是24,BF3与NO3-互为等电子体;
,无孤电子对,所以硝酸根的空间构型为平面三角形;等电子体是原子数相同、价电子数也相同的分子或离子,硝酸根的价电子数是24,BF3与NO3-互为等电子体;
(5)乙醇分子间存在氢键,氯乙烷分子间不能形成氢键,所以乙醇的沸点比氯乙烷高。
(6)由题图知,该晶胞中含有的Fe原子的个数为8×1/8+6×1/2=4,含有的N原子的个数为1,该晶体的化学式为Fe4N,该晶胞的质量为![]() g,两个最近的Fe原子间的距离为a cm,则晶胞边长
g,两个最近的Fe原子间的距离为a cm,则晶胞边长![]() cm,故该晶体的密度为
cm,故该晶体的密度为![]() g·cm-3=
g·cm-3= g·cm-3。
g·cm-3。

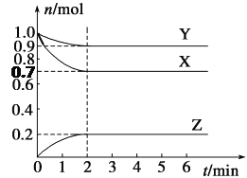
【题目】一定温度下,在2 L的恒容密闭容器中发生反应![]() 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为![]()
B.该反应在10 min后才达到平衡
C.平衡状态时,![]()
D.物质B的平衡转化率为20%