题目内容
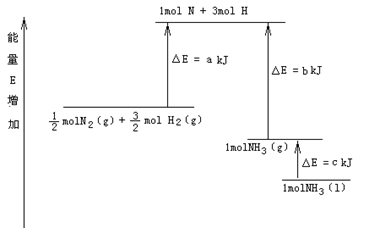
化学反应N2+3H2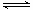 2NH3的能量变化如下图所示,该反应的热化学方程式是
2NH3的能量变化如下图所示,该反应的热化学方程式是
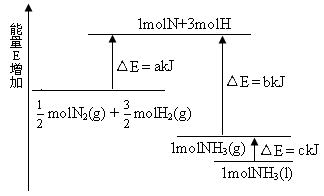
 2NH3的能量变化如下图所示,该反应的热化学方程式是
2NH3的能量变化如下图所示,该反应的热化学方程式是
A.N2(g)+3H2(g)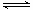 2NH3(1) △H=2(a-b-c)kJ·mol-1 2NH3(1) △H=2(a-b-c)kJ·mol-1 |
B.N2(g)+3H2(g)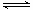 2NH3(g) △H=2(b-a)kJ·mol-1 2NH3(g) △H=2(b-a)kJ·mol-1 |
C.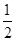 N2(g)+ N2(g)+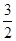 H2(g) H2(g) 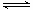 NH3(1) △H=(b+c-a)kJ·mol-1 NH3(1) △H=(b+c-a)kJ·mol-1 |
D.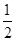 N2(g)+ N2(g)+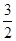 H2(g) H2(g) NH3(g) △H=(a+b)kJ·mol-1 NH3(g) △H=(a+b)kJ·mol-1 |
A
本题较新,也很有特色;重在看清图中标识,找准分子,原子变化过程中相应的能量变化。

图中a 为反应物键能之和;
图中b 为生成物键能之和;
图中c 为1 mol NH3液化时放出的能量。
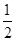 N2(g)+
N2(g)+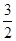 H2(g)
H2(g)  NH3(1) △H=(a-b-c)kJ·mol-1各项同时乘2得
NH3(1) △H=(a-b-c)kJ·mol-1各项同时乘2得N2(g)+3H2(g)
 2NH3(1) △H=2(a-b-c)kJ·mol-1
2NH3(1) △H=2(a-b-c)kJ·mol-1 
练习册系列答案
相关题目
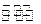 CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验: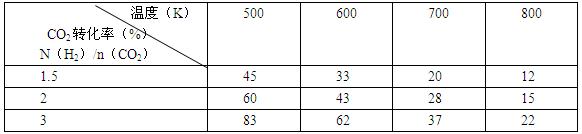
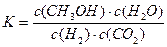
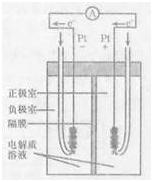

 2SO3(g) △H=-197kJ/ mol,对该热化学方程式理解为:在该条件下,向密闭容器中通入2摩SO2和1摩O2,达到平衡时放出热量是197 kJ
2SO3(g) △H=-197kJ/ mol,对该热化学方程式理解为:在该条件下,向密闭容器中通入2摩SO2和1摩O2,达到平衡时放出热量是197 kJ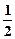 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=  (l)+O2(g) △H= -196.46kJ·mol-1
(l)+O2(g) △H= -196.46kJ·mol-1 1
1