题目内容
1.原电池发生的反应是可自发进行的氧化还原反应,CO/O2燃料电池以熔融状态的碳酸盐为电解质,下列说法正确的是( )| A. | 该电池电解质在固态时,电池无法工作 | |
| B. | CO32- 在电池内部向正极移动 | |
| C. | CO在正极通入 | |
| D. | 当有22.4LCO参加反应时电路中有2mol电子发生转移 |
分析 A.没有自由移动的离子时,原电池无法形成电流;
B.放电时,阴离子向负极移动;
C.燃料电池中,燃料在负极通入;
D.温度和压强未知,无法计算CO的物质的量.
解答 解:A.该电池电解质在固态时,电解质中不含自由移动的离子,电解质内部不能形成电流,导致不能形成闭合回路,则电池无法工作,故A正确;
B.放电时,阴离子CO32-向负极移动,故B错误;
C.燃料电池中,燃料CO失电子发生氧化反应,所以在负极通入,故C错误;
D.温度和压强未知,无法计算CO的物质的量,导致无法计算CO转移电子数,故D错误;
故选A.
点评 本题考查了燃料电池,明确正负极的判断、离子移动方向、原电池构成条件即可解答,注意C中气体摩尔体积的适用范围及适用条件,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.下列表示对应化学反应的离子方程式或化学方程式正确的是( )
| A. | 向NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 向NaAlO2溶液中通入过量CO2:2 AlO+CO2+3H2O═2Al(OH)3↓+CO | |
| D. | 以下有机物在碱性条件下水解的化学方程式: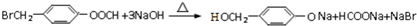 |
9.已知31g白磷变成红磷放出18.39kJ热量,下列两反应中:
P4(s)+5O2(g)═2P2O5(s)△H=Q1 kJ•mol-1
4P(红,s)+5O2(g)═2P2O5(s)△H=Q2kJ•mol-1
则下列说法中正确的是( )
P4(s)+5O2(g)═2P2O5(s)△H=Q1 kJ•mol-1
4P(红,s)+5O2(g)═2P2O5(s)△H=Q2kJ•mol-1
则下列说法中正确的是( )
| A. | Q1>Q2,白磷比红磷稳定 | B. | Q1>Q2,红磷比白磷稳定 | ||
| C. | Q1<Q2,白磷比红磷稳定 | D. | Q1<Q2,红磷比白磷稳定 |
6.N2O俗称“笑气”,曾用作可吸入性麻醉剂,产生N2O反应:3CO+2NO2═3CO2+N2O.下列说法正确的是( )
| A. | 反应中每生成l mol N2O,转移4mol电子 | |
| B. | N2O只有氧化性,无还原性 | |
| C. | N2O和CO2互为等电子体 | |
| D. | NO2属于酸性氧化物 |
13.下列说法中正确的是( )
| A. | 升高温度只能加快吸热反应的速率 | |
| B. | 对于任何反应,增大压强都可以加快反应速率 | |
| C. | 颗粒小的大理石和颗粒大的大理石跟同浓度的盐酸反应,前者反应速率快,是由于碳酸钙浓度大的缘故 | |
| D. | 催化剂能使可逆反应的正、逆反应速率同时加快 |
10.下列说法正确的是( )
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 同周期非金属氧化物对应水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
11.下列说法无科学性错误的是( )
| A. | 铅笔芯的原料是重金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒 | |
| B. | CO有毒,生有煤炉的居室,可放置数盆水,这样可有效地吸收CO,以防煤气中毒 | |
| C. | 油条制作中常加入明矾,不仅作为膨化剂,还有利于补充人体所需的微量元素 | |
| D. | 薯片、薯条等淀粉类油炸食品中丙烯酰氨(CH2=CHCONH2)含量较高,应谨慎食用 |
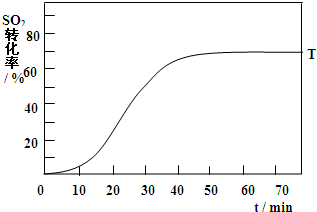 黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3.
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3.