题目内容
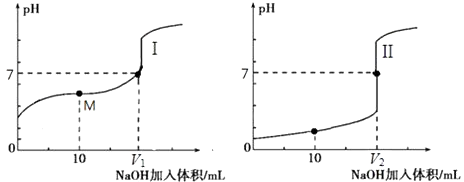
【题目】已知金属活动相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题: 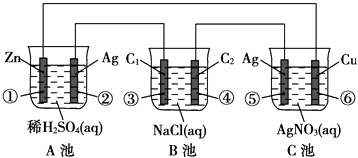
(1)各装置名称是:A池 , B池 .
(2)写出电极上发生的反应:① , ③ , ⑤ .
(3)当电路上有2mol电子流过时,①极上质量变化g,⑥极上质量变化g.
(4)反应进行一段时间后,A,B,C三池中电解质溶液浓度不变的是 .
【答案】
(1)原电池;电解池
(2)Zn﹣2e﹣═Zn2+;2Cl﹣﹣2e﹣═Cl2↑;Ag﹣e﹣═Ag+
(3)65;216
(4)C
【解析】解:(1)金属活动相差越大,形成原电池时越容易放电,在串联电路中充当电源,则A池为原电池,B、C为电解池,
所以答案是:原电池;电解池;(2)①为负极,②为正极,负极发生氧化反应,Zn失去电子生成Zn2+ , 电极反应式为:Zn﹣2e﹣═Zn2+ ,
③连接电源正极,为阳极,发生氧化反应,氯离子放电生成氯气,电极反应式为:2Cl﹣﹣2e﹣═Cl2↑,
⑤连接电源正极,为阳极,发生氧化反应,银放电生成银离子,电极反应式为:Ag﹣e﹣═Ag+ ,
所以答案是:Zn﹣2e﹣═Zn2+;2Cl﹣﹣2e﹣═Cl2↑;Ag﹣e﹣═Ag+;(3)根据电子转移守恒,反应的Zn的物质的量为 ![]() =1mol,参加反应Zn的质量为1mol×65g/mol=65g,即①极上质量减小65g;
=1mol,参加反应Zn的质量为1mol×65g/mol=65g,即①极上质量减小65g;
⑥为阴极,发生反应:Ag++e﹣═Ag,根据电子转移守恒,生成析出Ag为 ![]() =2mol,析出Ag的质量为2mol×108g/mol=216g,即⑥极上质量增大216g,
=2mol,析出Ag的质量为2mol×108g/mol=216g,即⑥极上质量增大216g,
所以答案是:65;216;(4)A、B、C三池中C为电镀池,阳极溶解的金属物质的量等于阴极析出金属物质的量且是同一种金属,所以相当于电解质溶液不参加反应,则电解质溶液浓度不变,
所以答案是:C.

 阅读快车系列答案
阅读快车系列答案【题目】已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)请根据上述信息判断下列反应不能发生的是 (填编号).
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
D.HCN+Na2CO3→NaCN+CO2+H2O
(2)已知常温时Ksp(AgCl)=1.8×10﹣10mol2L﹣2 , 向50mL 0.18molL﹣1的AgNO3溶液中加入相同体积0.22molL﹣1的盐酸,则c(Ag+)= .