题目内容
【题目】酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡.
(1)氨水是中学常见碱
①下列事实可证明氨水是弱碱的是(填字母序号).
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0.1molL﹣1氨水pH为11
C.铵盐受热易分解
D.常温下,0.1molL﹣1氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是(填字母序号).
A.通入氨气 B.加入少量氯化铁固体 C.加水稀释 D.加入少量氯化铵固体
(2)盐酸和醋酸是中学常见酸
用0.1molL﹣1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1molL﹣1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线.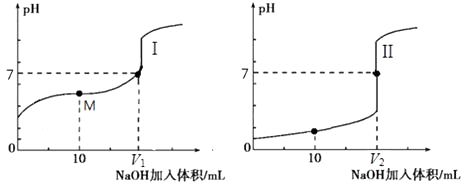
①滴定醋酸的曲线是(填“I”或“II”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是 .
③V1和V2的关系:V1V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 .
【答案】
(1)BD;BC
(2)I;0.1mol?L﹣1醋酸溶液;<;c(CH3COO﹣)>c (Na+)>c (H+)>c (OH﹣)
【解析】解:(1)①A.氨水和氯化亚铁反应生成氢氧化亚铁沉淀,说明一水合氨是碱,但不能说明一水合氨部分电离,所以不能说明是弱电解质,故A错误;
B.常温下,0.1molL﹣1氨水pH为11,溶液呈酸性,说明一水合氨部分电离,则说明一水合氨是弱电解质,故B正确;
C.铵盐受热易分解说明铵盐不稳定,不能说明一水合氨部分电离,则不能说明一水合氨是弱电解质,故C错误;
D.常温下,0.1mol/L的氯化铵溶液pH约为5,溶液呈酸性,说明氯化铵是强酸弱碱盐,则说明一水合氨是弱电解质,故D正确;
所以答案是:BD;
②A.通入氨气,氨水的浓度增大,电离程度减小,故A错误;
B.加入少量氯化铁固体,会消耗氢氧根离子,则促进一水合氨的电离,电离程度增大,故B正确;
C.加水稀释,促进一水合氨的电离,电离程度增大,故C正确;
D.加入少量氯化铵固体,铵根离子浓度增大,抑制氨水的电离,电离程度减小,故D错误;
所以答案是:BC;(2)①由图中未加NaOH时的pH可知,图Ⅰ中酸的pH大于1,图Ⅱ中酸的pH=1,说明Ⅱ为0.1mol/L的盐酸溶液,为醋酸溶液滴定过程,所以滴定醋酸的曲线是I,
所以答案是:I;
②0.1molL﹣1 NaOH溶液、0.1molL﹣1的盐酸中氢离子和氢氧根浓度都是0.1mol/L,对水的抑制作用一样,但是0.1mol/L醋酸溶液中氢离子浓度小于0.1mol/L,所以对水的电离抑制较小,即三种溶液中由水电离出的c(H+)最大的是0.1 molL﹣1醋酸溶液,所以答案是:0.1molL﹣1醋酸溶液;
③醋酸和氢氧化钠之间的反应,当恰好完全反应得到的醋酸钠显示碱性,要使得溶液显示中性,pH=7,需要醋酸稍过量,所以盐酸和氢氧化钠恰好完全反应,得到的氯化钠显示中性,所以V1<V2 , 所以答案是:<;
④用0.1molL﹣1 NaOH溶液10mL和溶液体积为20.00mL0.1molL﹣1的醋酸反应,得到的是醋酸和醋酸钠的混合物,显示酸性,此时离子浓度大小c(CH3COO﹣)>c (Na+)>c (H+)>c (OH﹣),所以答案是:c(CH3COO﹣)>c (Na+)>c (H+)>c (OH﹣).
【考点精析】认真审题,首先需要了解弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理).

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】反应①Fe(s)+CO2(g)FeO(s)+CO(g)△H1=akJmol﹣1 , 平衡常数为K;反应②CO(g)+ ![]() O2(g)CO2(g)△H2=bkJmol﹣1 . 测得在不同温度下,K值如表:
O2(g)CO2(g)△H2=bkJmol﹣1 . 测得在不同温度下,K值如表:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若500℃时进行反应①,CO2起始浓度为2mol/L,CO的平衡浓度为 .
(2)反应①中的a0(填“大于”、“小于”或“等于”).
(3)700℃时反应①达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有(填序号).
A.缩小反应器体积
B.通入CO2
C.升高温度到 900℃
D.使用合适的催化剂
(4)如图图象符合反应①的是(填序号)(图中φ是混合物中CO的含量;T为温度).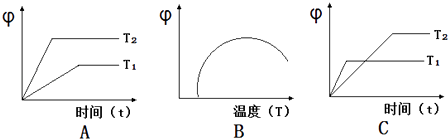
(5)反应③2Fe(s)+O2(g)═2FeO(s)△H3= .
【题目】在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s)═N2(g)+CO2(g)△H=﹣213.5kJ mol﹣1 , 达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | |
T2 | 0.25 |
下列说法不正确的是( )
A.上述信息可推知:T1<T2
B.T1℃时,该反应的平衡常数K= ![]()
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D.T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变