��Ŀ����
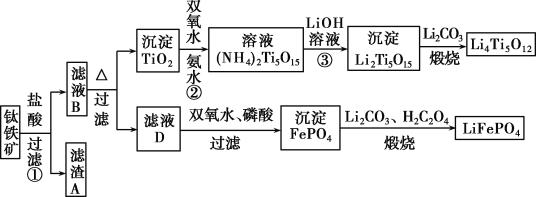
����Ŀ�����������Ҫ�ɷ�ΪFeTiO3(�ɱ�ʾΪFeO��TiO2)����������MgO��CaO��SiO2�����ʡ������������Ʊ�����ӵ�ص缫����(�����Li4Ti5O12�����������LiFePO4)�Ĺ�ҵ��������ͼ��ʾ��
��֪��FeTiO3�����ᷴӦ�����ӷ���ʽΪ��FeTiO3��4H����4Cl��=Fe2����TiOCl![]() ��2H2O��
��2H2O��
��1������ʵ���������չ���������õ����ֹ������ʵ������������������ƾ��ơ��������⣬����________(����������)�������ж���漰��������ϴ�ӳ����ķ����� ��
��2����������������A�Ʊ��뵼��ķ�Ӧ����ʽ��_________________��
��3����ҺB��TiOCl![]() ת������TiO2�����ӷ���ʽ��____________________��
ת������TiO2�����ӷ���ʽ��____________________��
��4����Ӧ���й���TiO2ת����(NH4)2Ti5O15��Һʱ��TiԪ�صĽ������뷴Ӧ�¶��йأ���Ӧ�¶ȹ���ʱ��TiԪ�ؽ����ʻ��½�����ԭ����__________ ____��
��5������ҺD�Ʊ�LiFePO4�Ĺ����У�����˫��ˮ��H2C2O4�����ʵ�������_________��
���𰸡�
��1�����Ǽܡ���������©���м�ˮ����û��������ˮ��Ȼ���º����ظ�2-3�Σ�
��2��2C+ SiO2![]() 2CO + Si��
2CO + Si��
��3��TiOCl42-+H2O=TiO2��+2H++4Cl-��
��4���¶ȹ���ʱ����Ӧ�ﰱˮ(��˫��ˮ)�����ֽ⣻
��5��1��1��
��������
�������������ʯ���������ܽ���˵õ�����Ϊ�������裬��ҺBΪMgCl2��CaCL2��FeCl2��TiCl2�����ȴٽ�ˮ�⣬���˵õ�����TiO2�������������Ͱ�ˮ��Ӧ�õ�(NH4)2Ti5O15���������������Һ�õ�����Li2Ti5O15����̼������յõ������Li4Ti5O12����ҺD����������������������ӣ���������õ�����������������̼��﮺Ͳ������յõ����������LiFePO4��
��1���ڿ��������չ�������Dʱ�����õ��������������������ǡ����Ǽܡ��ƾ��ƣ���������������ϴ�ӷ�������©���м�ˮ����û��������ˮ��Ȼ���º����ظ�2-3�Σ��ʴ�Ϊ�����Ǽܡ���������©���м�ˮ����û��������ˮ��Ȼ���º����ظ�2-3�Σ�
��2�����������ж������費�������ᣬ��������A�ɷ��Ƕ������裬����������̼�ڸ����·�Ӧ���ɹ��һ����̼����Ӧ����ʽΪ2C+ SiO2![]() 2CO + Si���ʴ�Ϊ��2C+ SiO2
2CO + Si���ʴ�Ϊ��2C+ SiO2![]() 2CO + Si��
2CO + Si��
��3���������̿�֪��TiOCl42-����Һ�м�����ˮ��Ӧ���ɶ������ѳ�������Ӧ�����ӷ���ʽΪ��TiOCl42-+H2O=TiO2��+2H++4Cl-���ʴ�Ϊ��TiOCl42-+H2O=TiO2��+2H++4Cl-��
��4�����ڶ��������백ˮ��˫��ˮ��Ӧ����(NH4)2Ti5O15ʱ���¶ȹ��ߣ�˫��ˮ�Ͱ�ˮ�����ֽ⣬���Է�Ӧ�¶ȹ���ʱ��TiԪ�ؽ������½����ʴ�Ϊ���¶ȹ���ʱ����Ӧ�ﰱˮ(��˫��ˮ)�����ֽ⣻
��5�����ݵ����غ㣬������Ԫ��ת�Ƶĵ��Ӿ͵�����������������ת�Ƶĵ���������˿ɵù�ϵʽ��H2O2��H2C2O4��˫��ˮ��H2C2O4�����ʵ�����Ϊ1��1���ʴ�Ϊ��1��1��