题目内容
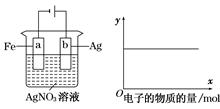
某混合溶液中只含有两种溶质NaCl和H2SO4,且n(NaCl)︰n(H2SO4)=3︰1。若以石墨电极电解该溶液,下列推断中不正确的是 ( )
| A.阴极产物为H2 | B.阳极先析出Cl2,后析出O2 |
| C.电解液的pH不断增大,最终大于7 | D.整个电解的过程实质是电解水 |
D
试题分析:在该溶液中,阳离子的放电能力:H+>Na+。阴离子的放电能力:Cl->OH->SO42-。A.在阴极首先应该是溶液中H+放电,所以阴极产物为H2。正确。B.在阳极首先是Cl-放电产生氯气;当Cl-反应完全后,OH-再放电产生氧气。因此阳极先析出Cl2,后析出O2。正确。C.由于电解过程中H+不断放电,所以溶液的c(OH-)不断增大,假设n(NaCl)=3mol,则n(H2SO4)=1mol.。若NaCl电解完全,会产生3mol的OH-。而H2SO4只能产生2mol的H+。后来电解实质是电极水。因此电解液的pH不断增大,最终大于7。正确。D.整个电解的过程开始滴加反应为2NaCl+2H2O
 Cl2↑+H2↑+2NaOH,后来是电解水。错误。
Cl2↑+H2↑+2NaOH,后来是电解水。错误。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。