题目内容
【题目】实验题:Ⅰ.下列实验设计或操作合理的是____________。
A.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯
B.只用水就能鉴别苯、硝基苯、乙醇
C.实验室制取乙烯时温度计的水银球在反应液上方
D.将10滴溴乙烷加入1 mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子
E.工业酒精制取无水酒精时先加生石灰然后蒸馏,蒸馏必须将温度计的水银球插入反应液中,测定反应液的温度
F.苯酚中滴加少量的稀溴水,可用来定量检验苯酚
G.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验
Ⅱ.学习卤代烃的性质时,张老师通过实验的方法验证溴乙烷在不同溶剂中与NaOH 反应生成不同的反应产物,请你一起参与他们的探究。
(1)张老师用如图所示装置进行实验:该实验的目的是__________;课上你所观察到的现象是_____;盛水试管(装置)的作用是________。
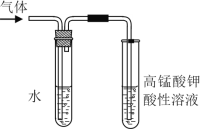
(2)若你用另一实验来达到张老师演示实验的目的,你设计的实验方案依据的反应原理是________(用化学方程式表示)。
【答案】BG 验证生成的气体是乙烯(或验证溴乙烷与NaOH发生消去反应的产物) KMnO4溶液的紫红色褪去 除去气体中少量的乙醇 CH2═CH2+Br2→CH2BrCH2Br
【解析】
Ⅱ(1)溴乙烷在NaOH乙醇溶液中发生的是消去反应生成乙烯;乙烯能使高锰酸钾溶液褪色;乙烯中含有乙醇,可以用水除去乙醇;
(2)根据乙烯的性质设计实验方案。
ⅠA.在催化剂存在的条件下,苯和液溴发生反应可生成比水重的溴苯,与溴水不反应,A错误;
B.苯、硝基苯、乙醇分别与水混合的现象为:分层后有机层在上层、分层后有机层在下层、不分层,现象不同,故只用水就能鉴别苯、硝基苯、乙醇,B正确;
C.实验室制取乙烯时控制反应液的温度为170℃,必须将温度计的水银球插入反应液中,测定反应液的温度,C错误;
D.将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子,检验Br-需要在酸性环境下,没有加酸至酸性,Ag+会与OH-反应,D错误;
E.工业酒精制取无水酒精时先加生石灰然后蒸馏,蒸馏必须将温度计的水银球放在烧瓶的支管口处,E错误;
F.苯酚中滴加少量的稀溴水,溴少量,没有完全反应,不能可用来定量检验苯酚,F错误;
G.将铜丝弯成螺旋状,在酒精灯上加热变黑后,生成CuO,立即伸入盛有无水乙醇的试管中,可完成乙醇氧化为乙醛的实验,G正确;
综上正确的是BG;
Ⅱ溴乙烷在NaOH水溶液中发生水解生成乙醇,溴乙烷在NaOH醇溶液中,发生消去反应生成乙烯。
(1)由图可知,高锰酸钾溶液可检验气体,则气体为乙烯,则溴乙烷发生消去反应生成乙烯,该实验的目的是:验证生成的气体是乙烯(或验证溴乙烷与NaOH发生消去反应的产物);实验中你所观察到的现象是KMnO4溶液的紫红色褪去;因乙醇也能被高锰酸钾氧化,可知盛水试管的作用是除去气体中少量的乙醇;
(2)乙烯含双键,性质活泼,可与溴水中溴发生加成反应使溴水褪色,故可把产生的气体直接通入溴水中,观察到溴水褪色从而验证生成的气体是乙烯,发生的反应的化学方程式为CH2═CH2+Br2→CH2BrCH2Br。

 教材全解字词句篇系列答案
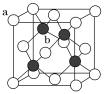
教材全解字词句篇系列答案【题目】Q、W、X、Y、Z五种短周期元素在周期表中的相对位置如下图所示,其中W的单质是一种重要半导体材料。
|
|
| Y |
|
Q | W | X |
| Z |
请按要求回答下列问题:
(1)Y的原子结构示意图为________;举一例说明Z的非金属性比X的非金属性强的事实:________。
(2)W、X、Y的原子半径由大到小依次![]() 填元素符号
填元素符号![]() ________:W与Z形成的化合物电子式为________。
________:W与Z形成的化合物电子式为________。
(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为________。
(4)已知: 2Na(s)+![]() Y2(g)=Na2Y(s)H=-414kJ/mol;2Na(s)+Y2(g)=Na2Y2(s)H=-511kJ/mol;则Na2Y(s)转变为Na2Y2(s)的反应一定条件下能自发进行的理由是________。将0.2mol Na2Y2加入到100mL1mol/L的QZ3中,充分反应的化学方程式为________。
Y2(g)=Na2Y(s)H=-414kJ/mol;2Na(s)+Y2(g)=Na2Y2(s)H=-511kJ/mol;则Na2Y(s)转变为Na2Y2(s)的反应一定条件下能自发进行的理由是________。将0.2mol Na2Y2加入到100mL1mol/L的QZ3中,充分反应的化学方程式为________。
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×10-12,则R(OH)2饱和溶液中c(OH-)=________mol/L。
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。