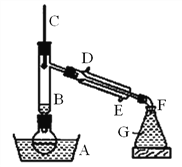
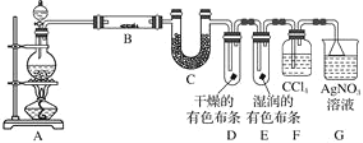
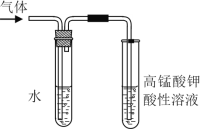
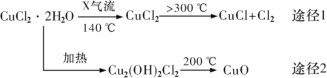题目内容
【题目】已知钼(Mo)的晶胞如图所示,钼原子半径为a pm,相对原子质量为M,以NA表示阿伏加德罗常数的值。
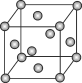
(1)钼晶体的堆积方式为_______________,晶体中粒子的配位数为________________。
(2)构成钼晶体的粒子是________(填“原子”,“分子”或“离子”),晶胞中所含的该种粒子数为___________。
(3)金属钼的密度为______________g·cm-3。
【答案】面心立方堆积 12 原子 4 ![]()
【解析】
(1)根据晶胞中原子的排列判断堆积方式;以顶点Mo原子判断距离最近的Mo原子数,确定配位数;
(2)均摊法确定晶胞中含有的粒子数;
(3)根据晶胞的质量和体积计算密度。
(1) 如图金属钼晶体中的原子堆积方式中,Mo原子处于立方体的面心与顶点,属于面心立方堆积;顶点Mo原子到面心Mo原子的距离最短,则晶体中粒子的配位数为3×8×![]() =12;
=12;
(2)构成钼晶体的粒子是原子,晶胞中所含的该种粒子数为6×![]() +8×
+8×![]() =4;
=4;
(3)晶胞的质量为![]() g,钼原子半径为a pm=a×10-10cm,晶胞的边长为2
g,钼原子半径为a pm=a×10-10cm,晶胞的边长为2![]() a×10-10cm,则晶胞的体积为=(2
a×10-10cm,则晶胞的体积为=(2![]() a×10-10)3cm3, 金属钼的密度为
a×10-10)3cm3, 金属钼的密度为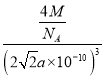 g·cm-3=
g·cm-3=![]() g·cm-3。
g·cm-3。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目