题目内容
【题目】某小组同学为探究加热条件下![]() 固体的分解反应,将一定量
固体的分解反应,将一定量![]() 固体在隔绝空气条件下充分加热,最终得到固体A。
固体在隔绝空气条件下充分加热,最终得到固体A。
(1)甲同学认为分解会产生![]() 气体,于是用________试纸检验反应后容器内气体,试纸颜色不变。
气体,于是用________试纸检验反应后容器内气体,试纸颜色不变。
(2)他们通过比较反应前后固体的水溶液在常温下的pH不同,初步证明了Na2SO3固体发生了分解:
①取a g Na2SO3固体配成100mL溶液,测溶液的pH1>7,用离子方程式表示其原因:__________。
②_________(填操作),测得溶液的pH2>pH1。
(3)该小组同学查阅资料并继续实验。资料显示:Na2SO3固体在隔绝空气加热时能分解得到两种盐;H2S是具有刺激性气味的气体,溶于水形成的氢硫酸是二元弱酸。
实验如下:
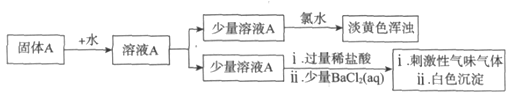
①加入氯水后的现象表明有硫单质生成,则说明固体A中含有_______离子。
②结合资料和实验,写出Na2SO3固体受热发生分解的化学方程式:____________。
(4)同学们根据(2)中pH2>pH1还得出结论:相同条件下HSO3-的电离能力强于HS-,理由是__________。
【答案】湿润的品红试纸(或湿润的蓝色石蕊试纸等合理答案)![]() 取a g固体A配成100 mL溶液
取a g固体A配成100 mL溶液![]()
![]() 同温度下,
同温度下,![]() 溶液浓度低时,碱性强于
溶液浓度低时,碱性强于![]() 溶液,说明
溶液,说明![]() 结合
结合![]() 的能力强于
的能力强于![]()
【解析】
(1)二氧化硫为酸性氧化物,能使紫色石蕊变红色,二氧化硫具有漂白性,能使品红褪色,故答案为:湿润的品红试纸(或湿润的蓝色石蕊试纸等合理答案);
(2) Na2SO3为强碱弱酸盐,亚硫酸根离子在溶液中发生水解而使溶液显碱性,为了实验的对照,在配制A的溶液时,也应配制成100ml的溶液,故答案为:SO32-+H2O![]() HSO3-+OH-;取a g固体A配成100 mL溶液;
HSO3-+OH-;取a g固体A配成100 mL溶液;
(3) ①硫离子易被氧化生成硫单质,呈淡黄色,故答案为S2-;②由实验现象可知A中含有硫酸根离子,由氧化还原反应规律可得反应的方程式为:4Na2SO3![]() 3Na2SO4+Na2S,故答案为:4Na2SO3
3Na2SO4+Na2S,故答案为:4Na2SO3![]() 3Na2SO4+Na2S;
3Na2SO4+Na2S;
(4)在相同条件下,弱酸根离子的水解程度越大,则其对应弱酸的的酸性越弱,A中固体配成溶液后浓度比配成的Na2SO3溶液的浓度小,而溶液的碱性反而强,说明S2-的水解能力强于SO32-,相同条件下HSO3-的电离能力强于HS-,故答案为:同温度下,Na2S溶液浓度低时,碱性强于Na2SO3溶液,说明S2-结合H+的能力强于SO32-。

 名校课堂系列答案
名校课堂系列答案