题目内容
含有硫的化合物在工业生产中应用广泛,回答下列问题:(1)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2.
①测得某黄铜矿(CuFeS2)中含硫20%(质量分数),求该矿石含铜的质量分数.
②现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:称取研细的黄铜矿样品1.150g,在空气中进行煅烧,生成Cu、Fe3O4和SO2气体,用100mL滴有淀粉的蒸馏水全部吸收SO2,然后取10mL吸收液,用0.05mol/L标准碘溶液进行滴定,用去标准碘溶液的体积为20.00mL.求该黄铜矿的纯度.
(2)将FeS和Fe2O3的混和物56.6g,用足量稀H2SO4溶解后可得3.2g硫,求原混和物中FeS的质量.
(3)一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收.利用下图装置加热无水硫酸铜粉末直至完全分解.若无水硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如下表所示.
| 装置 | A (试管+粉末) | B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.0g | 140.5g |
(4)硫化钠是用于皮革的重要化学试剂,可用无水Na2SO4与炭粉在高温下反应制得,化学方程式如下:
①Na2SO4+4C
 Na2S+4CO ②Na2SO4+4CO
Na2S+4CO ②Na2SO4+4CO Na2S+4CO2
Na2S+4CO2①若在反应过程中,产生CO和CO2混合气体为2mol,求生成Na2S的物质的量.
②硫化钠晶体放置在空气中,会缓慢氧化成Na2SO3,甚至是Na2SO4,现将43.72g部分变质的硫化钠样品溶于水中,加入足量盐酸后,过滤得4.8g沉淀和1.12L H2S 气体(标准状况,假设溶液中气体全部逸出),在滤液中加入足量的BaCl2后过滤得2.33g沉淀,分析该硫化钠样品的成分及其物质的量.

②该物质中铜和硫的质量分数相同,可以根据反应过程中的化学方程式和硫元素守恒计算得到硫元素质量分数即可;
(2)FeS和硫酸反应生成硫酸亚铁和硫化氢气体,氧化铁和硫酸反应生成硫酸铁和水,铁离子和硫化氢反应生成硫单质,依据硫单质计算硫化亚铁质量和氧化铁质量,过量的可以是氧化铁,也可以是硫化亚铁;
(3)由C装置中数据可知,碱石灰完全吸收了二氧化硫和三氧化硫,然后根据质量守恒定律分析每个装置的质量变化情况,从而分析反应中各物质的质量;
(4)①依据极值分析方法计算得到;
②Na2S与Na2SO3在酸性条件下发生反应:2Na2S+Na2SO3+6HCl=NaCl+3S↓+3H2O,故19.2g为硫的质量,放出H2S气体2.24L,还发生反应2HCl+Na2S=2NaCl+H2S↑,根据n=
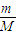 计算S的物质的量,进而计算生成S的反应中参加反应的Na2S、Na2SO3各自的物质的量,根据n=
计算S的物质的量,进而计算生成S的反应中参加反应的Na2S、Na2SO3各自的物质的量,根据n=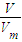 计算H2S的物质的量,进而计算与盐酸反应生成H2S气体需要Na2SO3的物质的量,再根据m=nM计算样品中Na2S、Na2SO3各自的质量,依据硫酸钡沉淀的质量,根据n=
计算H2S的物质的量,进而计算与盐酸反应生成H2S气体需要Na2SO3的物质的量,再根据m=nM计算样品中Na2S、Na2SO3各自的质量,依据硫酸钡沉淀的质量,根据n=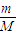 计算Na2SO4的物质的量.
计算Na2SO4的物质的量.解答:解:(1)①测得某黄铜矿(CuFeS2)中含硫20%(质量分数),化学式中铜摩尔质量和硫的摩尔质量之和相同,所以同物质中元素质量之比等于元素质量分数之比,铜的质量分数和硫元素质量分数相同为20%,
答:该矿石含铜的质量分数为20%;
②称取研细的黄铜矿样品1.150g,在空气中进行煅烧,生成Cu、Fe3O4和SO2气体,用100mL滴有淀粉的蒸馏水全部吸收SO2,然后取10mL吸收液,用0.05mol/L标准碘溶液进行滴定,用去标准碘溶液的体积为20.00mL,滴定过程发生的反应为SO2+I2+2H2O=2HI+H2SO4,二氧化硫物质的量n(SO2)=n(I2)=0.0200L×0.05mol/L=0.0010mol,所以100ml溶液中含二氧化硫物质的量为0.0100mol,依据硫元素守恒,硫元素物质的量0.01mol,CuFeS2的物质的量为0.005mol,黄铜矿的质量分数=
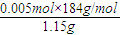 =80%;
=80%;答:该黄铜矿的纯度为80%;
(2)将FeS和Fe2O3的混和物56.6g,用足量稀H2SO4溶解后可得3.2g硫物质的量为0.1mol,FeS+H2SO4=FeSO4+H2S↑,Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3+H2S=2FeSO4+S↓+H2SO4,反应消耗的硫化亚铁和氧化铁质量可以依据化学方程式计算得到,m(FeS)=0.1mol×88g/mol=8.8g;m(Fe2O3)=0.1mol×160g/mol=16g,所以混合物中剩余56.6g-8.8g-16g=31.8g;若硫化亚铁过量则原混合物中硫化亚铁质量=56.6g-16g=40.6g;若氧化铁过量则硫化亚铁质量为8.8g,
答:原混和物中FeS的质量8.8g或40.6g;
(3)根据质量守恒定律分析,反应生成气体的质量为42.0g-37.0g=5g,生成氧化铜的质量为10g-5g=5g;干燥管完全吸收了二氧化硫和三氧化硫,其质量为79.5g-75g=4.5g,生成的氧气的质量为5g-4.5g=0.5g;则参加反应的硫酸铜和生成氧化铜及生成的氧气的质量比为10g:5g:0.5g=20:10:1,表现在化学方程式中的化学计量数之比为(20÷160):(10÷80):(1÷32)=4:4:1,依据原子守恒得到化学方程式为:4CuSO4
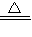 4CuO+2SO3↑+2SO2↑+O2↑;
4CuO+2SO3↑+2SO2↑+O2↑;答:4CuSO4
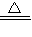 4CuO+2SO3↑+2SO2↑+O2↑;
4CuO+2SO3↑+2SO2↑+O2↑;(4)①反应①Na2SO4+4C
 Na2S+4CO ②Na2SO4+4CO
Na2S+4CO ②Na2SO4+4CO Na2S+4CO2
Na2S+4CO2若碳全部转化为二氧化碳的反应③Na2SO4+2C
 Na2S+2CO2
Na2S+2CO2若在反应过程中,产生CO和CO2混合气体为2mol,若全部转化为一氧化碳,时按照①反应生成硫化钠物质的量0.5mol,若全部生成二氧化碳按照反应③进行,反应生成硫化钠1mol;所以产生CO和CO2混合气体为2mol时 硫化钠物质的量为:0.5<n(Na2S)<1,
答:0.5<n(Na2S)<1;
②4.8g为硫的物质的量为
 =0.15mol,由方程式:2Na2S+Na2SO3+6HCl=NaCl+3S↓+3H2O可知,参加该反应的Na2S为0.15mol×
=0.15mol,由方程式:2Na2S+Na2SO3+6HCl=NaCl+3S↓+3H2O可知,参加该反应的Na2S为0.15mol× =0.1mol,Na2SO3的物质的量为0.15mol×
=0.1mol,Na2SO3的物质的量为0.15mol× =0.05mol,1.12LH2S气体的物质的量为
=0.05mol,1.12LH2S气体的物质的量为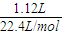 =0.05mol,根据反应2HCl+Na2S=2NaCl+H2S↑可知,参加该反应的Na2S的物质的量为0.05mol,故样品中Na2S的物质的量为0.15mol;在滤液中加入足量的BaCl2后过滤得2.33g沉淀为硫酸钡,物质的量为0.01mol,所以Na2SO4的物质的量为0.01mol;n(Na2S)=0.15 mol,质量为0.15mol×78g/mol=11.7g;n(Na2SO3)=0.05 mol,质量为0.05mol×126g/mol=6.3g;n(Na2SO4)=0.01 mol,质量为0.01mol×142g/mol=1.42g;结晶水的物质的量为=
=0.05mol,根据反应2HCl+Na2S=2NaCl+H2S↑可知,参加该反应的Na2S的物质的量为0.05mol,故样品中Na2S的物质的量为0.15mol;在滤液中加入足量的BaCl2后过滤得2.33g沉淀为硫酸钡,物质的量为0.01mol,所以Na2SO4的物质的量为0.01mol;n(Na2S)=0.15 mol,质量为0.15mol×78g/mol=11.7g;n(Na2SO3)=0.05 mol,质量为0.05mol×126g/mol=6.3g;n(Na2SO4)=0.01 mol,质量为0.01mol×142g/mol=1.42g;结晶水的物质的量为=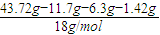 =1.35mol,
=1.35mol,答:n(Na2S)=0.15 mol;n(Na2SO3)=0.05 mol;n(Na2SO4)=0.01 mol,n(H2O)=1.35 mol.
点评:本题着重考查了化学方程式的计算,化合物纯度的分析计算应用,质量守恒定律的应用,解题的关键根据装置的质量差分析出各物质的质量,然后求出方程式中物质的化学计量数,混合物成分的分析判断,题目难度中等.

 同步拓展阅读系列答案
同步拓展阅读系列答案含有硫的化合物在工业生产中应用广泛,回答下列问题:
(1)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2。
①测得某黄铜矿(CuFeS2)中含硫20%(质量分数),求该矿石含铜的质量分数。
②现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:称取
研细的黄铜矿样品1.150g,在空气中进行煅烧,生成Cu、Fe3O4和SO2气体,用100 mL滴有淀粉的
蒸馏水全部吸收SO2,然后取10mL吸收液,用0.05mol/L标准碘溶液进行滴定,用去标准碘溶液的体
积为20.00mL。求该黄铜矿的纯度。
(2)将FeS和Fe2O3的混和物56.6 g,用足量稀H2SO4溶解后可得3.2 g硫,原混和物中FeS的质量。
(3)一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧
化钠溶液吸收。利用下图装置加热无水硫酸铜粉末直至完全分解。若无水硫酸铜粉末质量为10.0 g,
完全分解后,各装置的质量变化关系如下表所示。
|
装置 |
A(试管+粉末) |
B |
C |
|
反应前 |
42.0 g |
75.0 g |
140.0 g |
|
反应后 |
37.0 g |
79.0 g |
140.5 g |

请通过计算,推断出该实验条件下硫酸铜分解的化学方程式。
(4)硫化钠是用于皮革的重要化学试剂,可用无水Na2SO4与炭粉在高温下反应制得,化学方程式如下:
①Na2SO4
+ 4C Na2S + 4CO↑ ②Na2SO4
+ 4CO
Na2S + 4CO↑ ②Na2SO4
+ 4CO Na2S + 4CO2
Na2S + 4CO2
a.若在反应过程中,产生CO和CO2混合气体为2mol,求生成Na2S的物质的量。
b.硫化钠晶体放置在空气中,会缓慢氧化成Na2SO3,甚至是Na2SO4,现将43.72g部分变质的硫化钠样品溶于水中,加入足量盐酸后,过滤得4.8g沉淀和1.12L H2S 气体(标准状况,假设溶液中气体全部逸出),在滤液中加入足量的BaCl2后过滤得2.33g沉淀,分析该硫化钠样品的成分及其物质的量。
 含有硫的化合物在工业生产中应用广泛,回答下列问题:
含有硫的化合物在工业生产中应用广泛,回答下列问题:
(1)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2.
①测得某黄铜矿(CuFeS2)中含硫20%(质量分数),求该矿石含铜的质量分数.
②现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:称取研细的黄铜矿样品1.150g,在空气中进行煅烧,生成Cu、Fe3O4和SO2气体,用100mL滴有淀粉的蒸馏水全部吸收SO2,然后取10mL吸收液,用0.05mol/L标准碘溶液进行滴定,用去标准碘溶液的体积为20.00mL.求该黄铜矿的纯度.
(2)将FeS和Fe2O3的混和物56.6g,用足量稀H2SO4溶解后可得3.2g硫,求原混和物中FeS的质量.
(3)一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收.利用下图装置加热无水硫酸铜粉末直至完全分解.若无水硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如下表所示.
| 装置 | A (试管+粉末) | B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.0g | 140.5g |
(4)硫化钠是用于皮革的重要化学试剂,可用无水Na2SO4与炭粉在高温下反应制得,化学方程式如下:
①Na2SO4+4C
 Na2S+4CO ②Na2SO4+4CO
Na2S+4CO ②Na2SO4+4CO Na2S+4CO2
Na2S+4CO2①若在反应过程中,产生CO和CO2混合气体为2mol,求生成Na2S的物质的量.
②硫化钠晶体放置在空气中,会缓慢氧化成Na2SO3,甚至是Na2SO4,现将43.72g部分变质的硫化钠样品溶于水中,加入足量盐酸后,过滤得4.8g沉淀和1.12L H2S 气体(标准状况,假设溶液中气体全部逸出),在滤液中加入足量的BaCl2后过滤得2.33g沉淀,分析该硫化钠样品的成分及其物质的量.
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题: