题目内容
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
| A.开始加入合金的质量可能为16.4 g |
| B.参加反应的硝酸的物质的量为0.1 mol |
| C.生成沉淀完全时消耗NaOH溶液的体积为100 mL |
| D.标准状况下产物NO的体积为22.4 L |
C
合金增加的质量即为OH-的质量,则n(OH-)=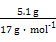 ="0.3" mol,
="0.3" mol,
V(NaOH溶液)= ="0.1" L,即为100 mL,C对;根据电子守恒和电荷守恒可知,反应中转移的电子为0.3 mol。若全部为Mg,质量为3.6 g,若全部是铜,质量为9.6 g,A错;被还原的硝酸为0.1 mol,起酸性作用的硝酸为0.3 mol,B错;标准状况下产物NO的体积为2.24 L,D错。
="0.1" L,即为100 mL,C对;根据电子守恒和电荷守恒可知,反应中转移的电子为0.3 mol。若全部为Mg,质量为3.6 g,若全部是铜,质量为9.6 g,A错;被还原的硝酸为0.1 mol,起酸性作用的硝酸为0.3 mol,B错;标准状况下产物NO的体积为2.24 L,D错。
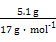 ="0.3" mol,
="0.3" mol,V(NaOH溶液)=
 ="0.1" L,即为100 mL,C对;根据电子守恒和电荷守恒可知,反应中转移的电子为0.3 mol。若全部为Mg,质量为3.6 g,若全部是铜,质量为9.6 g,A错;被还原的硝酸为0.1 mol,起酸性作用的硝酸为0.3 mol,B错;标准状况下产物NO的体积为2.24 L,D错。
="0.1" L,即为100 mL,C对;根据电子守恒和电荷守恒可知,反应中转移的电子为0.3 mol。若全部为Mg,质量为3.6 g,若全部是铜,质量为9.6 g,A错;被还原的硝酸为0.1 mol,起酸性作用的硝酸为0.3 mol,B错;标准状况下产物NO的体积为2.24 L,D错。
练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目

 3Cu2++2R+yH2O。
3Cu2++2R+yH2O。
 6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。
6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。 +O2↑。下列对此反应的说法中,不正确的是( )
+O2↑。下列对此反应的说法中,不正确的是( ) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O