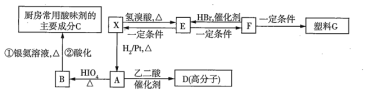
题目内容
【题目】伏打电堆由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布。如图所示为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成。下列说法正确的是
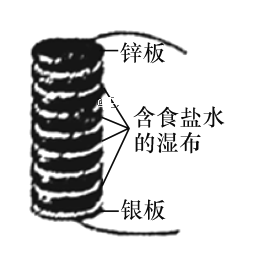
A.该电池发生的反应为析氢腐蚀
B.电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag2O
C.当电路中转移0.1 mol电子时,消耗锌板的总质量为26 g
D.该伏打电堆工作时,在银板附近会有Cl2放出
【答案】C
【解析】
根据题中伏打电堆模型可知,本题考查原电池和电解池的工作原理,运用原电池和电解池的工作原理分析。
A.电解质溶液是食盐水,不是酸性环境,则该电池发生的反应为吸氧腐蚀,A项错误;
B.根据电池总反应2Zn+O2+2H2O=2Zn(OH)2可知电池长时间工作后,中间的布上出现白色固体颗粒应是Zn(OH)2,B项错误;
C.负极反应为Zn2e=Zn2+,转移电子0.1mol时,一组锌消耗的质量为0.05mol×65g/mol=3.25g,八组锌消耗的总质量为3.25g×8=26g,C项正确;
D.银作正极,正极上氧气得电子发生还原反应,不会有氯气放出,D项错误;
答案选C。

练习册系列答案
相关题目