题目内容
W、X、Y、Z四种短周期元素。已知X原子的核外电子数和Ne原子相差1,在同周期中X原子半径最大,W、Y、Z在周期表中的相对位置如图,Z的非金属性在同周期元素中最强。下列说法不正确的是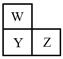
| A.简单离子半径:Y>X |
| B.最高价氧化物对应水化物的酸性:Z>Y |
| C.W与X形成的化合物属于离子化合物 |
| D.W、X、Z只能形成一种化合物 |
D
解析试题分析:X原子的核外电子数和Ne原子相差1,在同周期中X原子半径最大,所以X是钠。W、Y、Z在周期表中的相对位置如图,Z的非金属性在同周期元素中最强,则Z是氯元素,Y是S,W是O。A、硫离子含有3个电子层,钠离子是2个电子层,所以简单离子半径:Y>X,A正确;B、氯元素的非金属性强于硫元素,非金属性越强,最高价氧化物对应水化物酸性越强,则最高价氧化物对应水化物的酸性:Z>Y,B正确;C、钠与氧元素形成的化合物是离子化合物,例如氧化钠和过氧化钠,C正确;D、W、X、Z可以形成多种化合物,例如硫酸钠、亚硫酸钠、硫代硫酸钠等,D不正确,答案选D。
考点:考查位置、结构与性质的应用

练习册系列答案
相关题目
今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有
| A.碱性:KOH>NaOH | B.相对分子质量:Ar>K |
| C.酸性:HClO4>H2SO4 | D.元素的金属性:Mg>Al |
O、W、X、Y、Z五种短周期元素在元素周期表中的相对位置如图所示,W是大气中含量最高的元素,由此可知 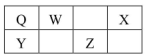
A.Q的一种核素中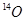 的质子数和中子数相等 的质子数和中子数相等 |
| B.X的最高正化合价与最低负化合价的绝对值之差为6 |
| C.Y是常见的半导体材料 |
| D.Z的氧化物的水化物是强酸 |
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,
| | R | | |
| T | Q | | W |
其中T所处的周期序数与族序数相等。下列判断不正确的是
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
| A.微粒X2-与Y2+核外电子排布相同,离子半径:X2-> Y2+ |
| B.人们可在周期表的过渡元素中寻找催化剂、耐腐蚀和耐高温的合金材料 |
| C.由水溶液的酸性:HCl>HF,可推断出元素的非金属性:Cl>F |
| D.Be元素与Al元素同处在周期表的金属与非金属的交界处,可推出: |
下列说法正确的是
| A.某粒子的电子数等于质子数,则该粒子可能是一种分子或一种离子 |
| B.构成单质的分子中一定含有共价键 |
| C.溶液和胶体的本质区别是有无丁达尔效应 |
| D.化学变化不产生新元素,产生新元素的变化不是化学变化 |
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能为 ( )
| A.X+32 | B.X+4 | C.X+8 | D.X+18 |
右表为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述中,正确的是( )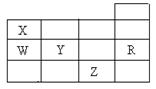
| A.常温下,Z单质为气态物质 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的稳定性要比X的氢化物的稳定性强 |
| D.Y元素的非金属性比W元素的非金属性强 |
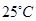 )。它们满足如图转化关系,则下列说法正确的是( )
)。它们满足如图转化关系,则下列说法正确的是( )