题目内容
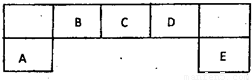
短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题(1)描述D在元素周期表中的位置:
(2)比较A、C、D元素简单离子半径的大小: > > (填微粒符号)
(3)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因:
(4)C的氢化物与其最高价氧化物对应的水化物反应,产物溶于水呈 性,用离子方程式解释原因 .
(5)D原子与氢原子可形成10电子阳离子,写出该阳离子的电子式
(6)E的最高价氧化物的水化物的化学式为 .E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,该反应的化学反应方程式为 .
【答案】分析:短周期元素A、B、C、D、E,B元素形成的化合物在自然界中的种类最多,则B为C元素,由元素在周期表中的位置依次推出C为N,D为O,A为Al,E为Cl,然后利用元素及其单质、化合物的性质来解答.
解答:解:短周期元素A、B、C、D、E,B元素形成的化合物在自然界中的种类最多,则B为C元素,由元素在周期表中的位置依次推出C为N,D为O,A为Al,E为Cl,
(1)O元素在周期表中第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)A、C、D元素简单离子具有相同的电子排布,则原子序数大的离子半径小,所以离子半径为N3->O2->Al3+,故答案为:N3-;O2-;Al3+;
(3)F与D同主族且相邻,则F为S,因非金属性O>S,则O的氢化物比S的氢化物稳定,故答案为:N的非金属性比S强;
(4)C的氢化物为氨气,与其最高价氧化物对应的水化物硝酸,二者反应生成硝酸铵,因铵根离子水解使溶液显酸性,水解离子反应为NH4++H2O?NH3.H2O+H+,
故答案为:酸;NH4++H2O?NH3.H2O+H+;
(5)D原子与氢原子可形成10电子阳离子为H3O+,其电子式为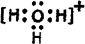 ,故答案为:
,故答案为: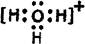 ;
;
(6)E的最高价为+7价,则最高价氧化物的水化物的化学式为HClO4,E的氢化物为HCl,其最高价氧化物的水化物的钾盐为KClO4,二者共热能发生反应生成一种气体单质为Cl2,由质量守恒定律可知还生成KCl和水,
化学反应为8HCl+KClO4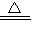 KCl+4Cl2↑+4H2O,故答案为:HClO4;8HCl+KClO4
KCl+4Cl2↑+4H2O,故答案为:HClO4;8HCl+KClO4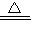 KCl+4Cl2↑+4H2O.
KCl+4Cl2↑+4H2O.
点评:本题考查元素周期表和元素周期律,元素的推断是解答的关键,并熟悉非金属的比较、半径的比较、水解、电子式、化学反应等知识点来解答,难度不大.
解答:解:短周期元素A、B、C、D、E,B元素形成的化合物在自然界中的种类最多,则B为C元素,由元素在周期表中的位置依次推出C为N,D为O,A为Al,E为Cl,
(1)O元素在周期表中第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)A、C、D元素简单离子具有相同的电子排布,则原子序数大的离子半径小,所以离子半径为N3->O2->Al3+,故答案为:N3-;O2-;Al3+;
(3)F与D同主族且相邻,则F为S,因非金属性O>S,则O的氢化物比S的氢化物稳定,故答案为:N的非金属性比S强;
(4)C的氢化物为氨气,与其最高价氧化物对应的水化物硝酸,二者反应生成硝酸铵,因铵根离子水解使溶液显酸性,水解离子反应为NH4++H2O?NH3.H2O+H+,
故答案为:酸;NH4++H2O?NH3.H2O+H+;
(5)D原子与氢原子可形成10电子阳离子为H3O+,其电子式为
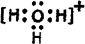 ,故答案为:
,故答案为: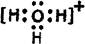 ;
;(6)E的最高价为+7价,则最高价氧化物的水化物的化学式为HClO4,E的氢化物为HCl,其最高价氧化物的水化物的钾盐为KClO4,二者共热能发生反应生成一种气体单质为Cl2,由质量守恒定律可知还生成KCl和水,
化学反应为8HCl+KClO4
 KCl+4Cl2↑+4H2O,故答案为:HClO4;8HCl+KClO4
KCl+4Cl2↑+4H2O,故答案为:HClO4;8HCl+KClO4 KCl+4Cl2↑+4H2O.
KCl+4Cl2↑+4H2O.点评:本题考查元素周期表和元素周期律,元素的推断是解答的关键,并熟悉非金属的比较、半径的比较、水解、电子式、化学反应等知识点来解答,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目