题目内容
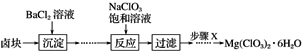
【题目】某研究小组同学在实验室用卤块制备少量Mg(ClO3)2·6H2O,其流程如图所示:
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)的变化曲线如图所示。

③形成氢氧化物沉淀时,不同离子对应溶液的pH如下:Fe2+开始沉淀的pH为5.8,完全沉淀的pH为8.8;Fe3+开始沉淀的pH为1.1,完全沉淀的pH为3.2;Mg2+开始沉淀的pH为8.2,完全沉淀的pH为11。
④可选用的试剂:H2O2、稀硫酸、KMnO4溶液、MgCl2溶液、MgO。
(1)步骤X包含的操作为___________、 ___________、____________、过滤洗涤并干燥。
(2)加入BaCl2溶液沉淀后需经过两步实验步骤才进行下步反应,请写出这两步实验步骤:
①________________________________________________________________________;
② _______________________________________________________________________;
(3)加入NaClO3饱和溶液发生反应的化学方程式为_______________________________。
(4)将Mg(ClO3)2加入到含有KSCN的FeSO4溶液中立即出现红色,写出相关反应的离子方程式______________。
【答案】 蒸发结晶 趁热过滤 冷却结晶 向溶液中加入稍过量双氧水,充分反应 向溶液中加入氧化镁调节pH为3.2~8.2. MgCl2+2NaClO3===Mg(ClO3)2+2NaCl↓ ClO+6Fe2++6H+===6Fe3++Cl-+3H2O
【解析】卤块的成分有MgCl2·6H2O、MgSO4、FeCl2,加入氯化钡溶液后,可以将硫酸根离子转化为硫酸钡沉淀,再向反应后的溶液中加入氧化剂,亚铁离子可以被氧化为三价铁离子,加入氧化镁,调节pH可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁,加入饱和氯酸钠溶液得到氯酸镁,可以根据物质的溶解度受温度的影响情况来获得要制取的物质,据此解答。
卤块的成分有MgCl2·6H2O、MgSO4、FeCl2,加入氯化钡溶液后,可以将硫酸根离子转化为硫酸钡沉淀,再向反应后的溶液中加入氧化剂,亚铁离子可以被氧化为三价铁离子,加入氧化镁,调节pH可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁,加入饱和氯酸钠溶液得到氯酸镁,可以根据物质的溶解度受温度的影响情况来获得要制取的物质,则
(1)根据物质的溶解度大小可判断,溶液获得晶体的方法:蒸发浓缩,趁热过滤,冷却结晶、过滤、洗涤、干燥;
(2)由于不能引入新杂质,所以选择绿色氧化剂双氧水氧化亚铁离子,利用氧化镁调节pH,即这两步实验步骤分别为向溶液中加入稍过量双氧水,充分反应;向溶液中加入氧化镁调节pH为3.2~8.2;
(3)由于氯化钠的溶解度最小,所以根据以上分析可知加入NaClO3饱和溶液发生反应的化学方程式为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓。
(4)将Mg(ClO3)2加入到含有KSCN的FeSO4溶液中立即出现红色,这是由于氯酸根离子具有氧化性,可以将亚铁离子氧化为铁离子,反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O。

【题目】向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,符合图像的一组是

X | Y | |
A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
D | NaAlO2、氨水、NaOH | H2SO4 |
【题目】针对下列9种元素,完成以下各小题
周期 | IA | ⅡA | ⅢA | ⅣA | ⅥA | ⅦA | O | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)常见单质为有色气体的元素是_______(填名称)。
(2)用电子式表示元素④和⑨形成化合物的过程_________。
(3)最高价氧化物对应的水化物中酸性最强的是_________(填化学式)。
(4)④和⑥两者的最高价氧化物对应的水化物反应的离子方程式为_______。
(5)⑦的单质的用途正确的是_____。
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(6)元素①和⑦非金属性较强的是____(填写元素符号),写出一个能表示二者非金属性强弱关系的化学方程式为:_______ 。