��Ŀ����
����Ŀ��ǿ����ǿ���ϡ��Һ��Ӧ���Ȼ�ѧ����ʽΪH��(aq)��OH��(aq)===H2O(l) ��H����57.3 kJ��mol��1����1L0.5mol��L��1��NaOH��Һ�м����������ʣ���ϡ���ᡢ��Ũ���ᡢ��ϡ���ᣬǡ����ȫ��Ӧ����ЧӦ�ֱ�Ϊ��H1����H2����H3�����ߵĹ�ϵ��ȷ���ǣ� ��
A.��H1>��H2>��H3B.��H1<��H3<��H2
C.��H1����H3>��H2D.��H1>��H3>��H2
���𰸡�D
��������
��Ϊ������������ʣ�����ʱ���ȣ�Ũ��������ˮʱ���ȣ����кͷ�Ӧʱ�ų�������Q(Ũ����)��Q(ϡ����)��Q(ϡ����)��������ȷ�Ӧ�У���HΪ��ֵ������H=-Q������H2����H3����H1����ѡD��

��ϰ��ϵ�д�
�����Ŀ
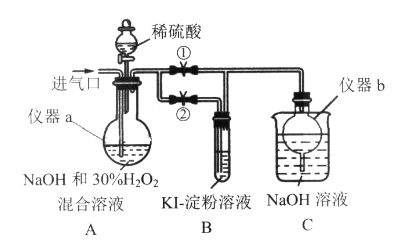
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ�Լгֺ;���װ�ã����ô�װ�úͱ����ṩ��������������ʵ�����
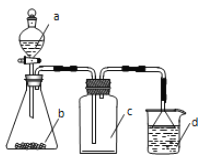
ѡ�� | a������ | b������ | c�е����� | d������ |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | ϡ���� | Cu | NO | H2O |
C | ���� | Na2CO3 | CO2 | NaOH��Һ |
D | Ũ���� | MnO2 | Cl2 | NaOH��Һ |
A. AB. BC. CD. D