题目内容
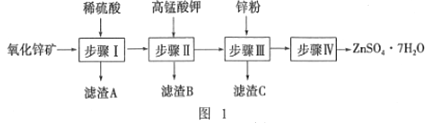
【题目】(1)燃料电池已广泛应用于航空领域。如图是一种新型燃料电池装置,其总反应方程式为N2H4+O2=N2+2H2O,通入N2H4(肼)的一极是电池的_______(填“正极”或“负极”),该电极的电极反应式为_________________。放电过程中,溶液中的阳离子移向_______(填“正极”或“负极”)。
(2)在上述燃料电池中,若完全消耗16 g N2H4,则理论上外电路中转移电子的物质的量为________ mol,消耗氧气的体积为________ L(标准状况)。
(3)与传统火力发电相比,燃料电池的优点是_________、________。
【答案】 负极 N2H4+4OH――4e-=N2+4H2O 正极 2 11.2 高效(能量转化率高) 环境友好(排出物不污染环境)
【解析】(1)根据总反应方程式为N2H4+O2=N2+2H2O可知肼是还原剂,氧气是氧化剂,因此通入N2H4(肼)的一极是电池的负极,电解质溶液显碱性,因此该电极的电极反应式为N2H4+4OH――4e-=N2+4H2O。放电过程中,溶液中的阳离子移向正极。(2)16gN2H4是0.5mol,则理论上外电路中转移电子的物质的量为0.5mol×2=2.0mol,消耗氧气的物质的量是2mol÷4=0.5mol,在标准状况下的体积为11.2L。(3)与传统火力发电相比,燃料电池的优点是能量转化率高、排出物不污染环境,环境友好。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】某同学设计计如下图所示装罝(部分夹持装置己略去)进行实验探究:
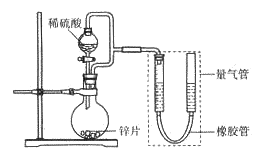
(1)用上述装置探究影响化学反应速率的因素。以生成9.0 mL气体为计时终点,结果为t1>t2。
序号 | V(H2SO4)/mL | C(H2SO4)/mol·L-1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
①比较实验I和Ⅱ可以得出的实验结论是_______________。
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是_________(填序号)。
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用________(填序号)。
A.稀HCl B .NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_____________。