题目内容
【题目】【安徽省黄山市2017届高三第二次模拟考试理科综合】
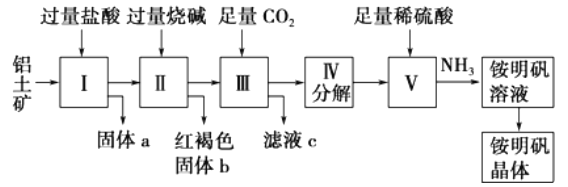
硫酸锌用于制造立德粉,并用作媒染剂、收敛剂、木材防腐剂等.现欲用氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)为原料生产ZnSO4·7H2O, 工艺流程如图l:
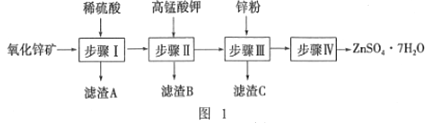
(l)步骤I的操作是_____,滤渣A的主要成分是_____。
(2)步骤I加入稀硫酸进行酸浸时,需不断通入高温水蒸气,其目的是______。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾溶液,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为_____________。
(4)步骤Ⅲ得到的滤液中,阳离子是___________。(不考虑H+)
(5)步骤IV中的烘干操作需在减压低温条件下进行,其原因是_______。
(6)取28.70 gZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图2所示。650℃时所得固体的化学式为_______(填字母序号)。

a. ZnO b. Zn3O(SO4)2 c. ZnSO4 d. ZnSO4·H2O
【答案】 过滤 H2SiO3 升高温度,加快反应速率 3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+ Zn2+、K+ 防止ZnSO4·7H2O分解,并减少ZnSO4水解 b
【解析】氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,反应生成硅酸不溶,过滤分离,滤液中加入高锰酸钾溶液与亚铁离子反应生成MnO(OH)2和氢氧化铁沉淀,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液为硫酸锌,蒸发浓缩、冷却结晶、过滤得到ZnSO47H2O晶体。
(1)步骤Ⅰ加入硫酸,加稀硫酸充分浸泡,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,ZnSiO3与硫酸反应生成硅酸不溶,过滤分离,得到滤渣A为H2SiO3,故答案为:过滤;H2SiO3;
(2)步骤Ⅰ加入稀硫酸进行触浸时,需不断通入高温水蒸气,可增大反应的温度,使反应物充分混合,加快反应速率,故答案为:升高温度,使反应物充分混合,以加快反应速率;
(3)在PH约为5.1的滤液中加入高锰酸钾,与亚铁离子反应生成MnO(OH)2和氢氧化铁沉淀,该反应的离子方程式为:3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+,故答案为:3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+;
(4)步骤Ⅲ加锌粉置换铜离子,过滤得到硫酸锌和硫酸钾溶液,滤液中含有Zn2+,K+,故答案为:Zn2+、K+;
(5)ZnSO47H2O在温度较高时易失去结晶水,需在减压低温条件下干燥,故答案为:防止ZnSO4·7H2O分解,并减少ZnSO4水解;
(6)28.70 g ZnSO47H2O的物质的量为0.1mol,若得ZnSO4H2O的质量为17.90g,则温度为100℃;若得ZnSO4的质量为16.10g,则温度为250℃;若得ZnO的质量为8.10g,则温度为930℃,据此通过排除法确定680℃时所得固体的化学式为Zn3O(SO4)2;故选b。
【名师点评】本题以ZnSO47H2O的制备为载体,考查了基本实验操作、氧化还原反应、化学反应速率的影响因素、陌生方程式的书写、化学计算等知识。(6)中注意利用特殊值进行解答是本题的易错点和难点。

 能考试全能100分系列答案
能考试全能100分系列答案