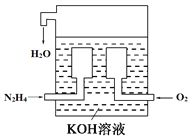
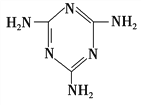
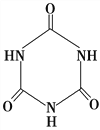
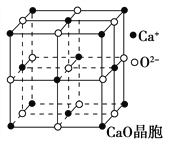
题目内容
【题目】下列描述中正确的是 ( )
A. CS2为V形的极性分子 B. ClO3—的空间构型为平面三角形
C. SiF4和SO32—的中心原子均为sp2杂化 D. SF6中有6对相同的成键电子对
【答案】D
【解析】A. CS2与CO2是等电子体,所以与二氧化碳相似,是直线形的非极性分子,A不正确; B. ClO3—的中心原子的价电子对数=![]() =4,因此其价层电子对互斥模型为正四面体,由于离子中只形成了3个σ键,所以其空间构型为三角锥形,B不正确;C. SiF4和SO32—的中心原子的价层电子对数均为4,所以中心原子均为sp3杂化 ,C不正确; D. SF6分子构型为正八面体,中心原子S原子与6个F原子形成了6个σ键,所以有6对相同的成键电子对,D正确。
=4,因此其价层电子对互斥模型为正四面体,由于离子中只形成了3个σ键,所以其空间构型为三角锥形,B不正确;C. SiF4和SO32—的中心原子的价层电子对数均为4,所以中心原子均为sp3杂化 ,C不正确; D. SF6分子构型为正八面体,中心原子S原子与6个F原子形成了6个σ键,所以有6对相同的成键电子对,D正确。

练习册系列答案
相关题目
【题目】【河北省邢台市第二中学2017届高三上学期第三次月考】下述实验不能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 将 | 制备 |
B | 向沸水中滴加几滴 | 制备 |
C | 向某溶液中加入稀 | 检验溶液中是否含有 |
D | 相同温度下,测定浓度分别为0.1mol·L-1的 | 比较 |