题目内容
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42﹣![]() 2PbSO4+2H2O则下列说法正确的是( )
2PbSO4+2H2O则下列说法正确的是( )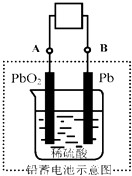
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb﹣2e﹣+SO42﹣ ![]() PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4﹣2e﹣+2H2O=PbO2+SO42﹣+4H+
【答案】D
【解析】A.放电时,Pb极即B极为电池负极,PbO2极即A极为正极,电子流动方向由负极经导线流向正极,即由B经导线流向A,故A不符合题意;
B、由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb﹣2e﹣+SO42﹣=PbSO4,正极上PbO2得电子被还原,电极反应式为PbO2+SO42﹣+2e﹣+4H+═PbSO4+2H2O,故B不符合题意;
C、在充电时,铅蓄电池的负极的逆反应是还原反应,应与充电器电源的负极相连,故C不符合题意;
D、在充电时,阳极上发生氧化反应,和放电时的正极反应互为逆反应,即PbSO4﹣2e﹣+2H2O=PbO2+SO42﹣+4H+,故D符合题意.
所以答案是:D.

 出彩同步大试卷系列答案
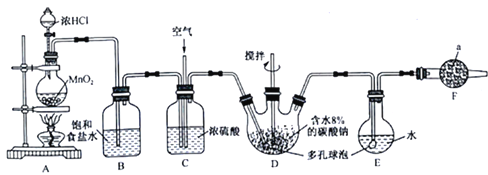
出彩同步大试卷系列答案【题目】Cl2O为国际公认的高效安全灭菌消毒剂之一,实验室可利用氧气和空气(氯气与空气体积比为1∶3,空气不参与反应)的混合气与含水8%的碳酸钠反应制备,所用实验装置和Cl2O的性质如下:
颜色 | 棕黄色 |
状态 | 气体 |
气味 | 强刺激性 |
熔点 | -116℃ |
沸点 | 3.8℃ |
水溶性 | 极易溶于水,与水反应生成次氯酸 |
热稳定性 | 42℃以上,分解为Cl2和O2 |
回答下列问题:
(1)仪器a的名称为_______________,所盛放的药品是_____________________。
(2)写出装置A 中发生的离子方程式:_____________________________。
(3)装置C的主要作用是_______________________________________。
(4)装置D、E 中都用到多孔球泡,其作用是____________________________。
(5)写出装置D生成Cl2O的化学方程式:___________________________。
(6)Cl2O是一种更为理想的饮用水消毒剂,ClO2和Cl2O在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2O的______________ (结果保留两位小数)倍。
(7)装置E中所得溶液呈黄绿色,可能的原因是D中的氯气过量进入E中,设计实验证明:____________________________________________________________。
(8)制备Cl2O装置中存在缺陷,请提出改进措施:_____________________________。