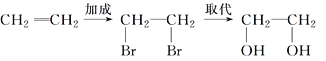题目内容
【题目】下列物质中,不属于铁合金的是( )
A.球墨铸铁B.不锈钢C.锰钢D.氧化铁
【答案】D
【解析】
根据题中铁合金可知,本题考查铁合金的概念,运用铁与一种或几种元素组成的中间合金称为铁合金分析。
A.球墨铸铁是铁、碳、硅、锰形成的合金,故A不符合题意;
B.不锈钢是铁、铬、镍形成的合金,故B不符合题意;
C.锰钢是铁、锰、碳形成的合金,故C不符合题意;
D.氧化铁是金属氧化物,不属于合金,故D符合题意;
答案选D。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目