题目内容
2.某二价金属元素R,在自然界中里面有三种同位素,所含中子数分别为12、13和14,且含13个中子的同位素的摩尔分数为10.13%,又知:1.216g R单质与足量盐酸发生反应,在标准状况下放出1.12L氢气.试计算:(1)R元素的相对原子质量;
(2)含12个中子的同位素的摩尔分数.
分析 (1)设R元素相对原子质量为a,根据电子转移守恒列方程计算;
(2)根据相对原子质量可以确定R元素,进而确定其质子数,计算各同位素质量数,设含12个中子的同位素的摩尔分数为x,则含14个中子的同位素的摩尔分数为(1-x-10.13%),根据元素相对原子质量列方程解答.
解答 解:(1)设R元素相对原子质量为a,根据电子转移守恒:$\frac{1.216}{a}$×2=$\frac{1.12}{22.4}$×2,解得a=24.32,
答:R元素相对原子质量为24.32;
(2)由相对原子质量可知,R为Mg元素,中子数分别为12、13和14的Mg的质量数分别为24、25、26,设含12个中子的同位素的摩尔分数为x,则含14个中子的同位素的摩尔分数为(1-x-10.13%),则:24x+25×10.13%+26×(1-x-10.13%)=24.32,解得x=78.935%,
答:含12个中子的同位素的摩尔分数为78.935%.
点评 本题考查化学方程式计算、相对原子质量,难度不大,注意掌握原子的相对原子质量、近似相对原子质量与元素相对原子质量、近似相对原子质量.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
12.科学家最近在-100℃的低温下合成了一种键线式为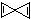 的烃X,根据分析,下列说法中不正确的是( )
的烃X,根据分析,下列说法中不正确的是( )
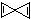 的烃X,根据分析,下列说法中不正确的是( )
的烃X,根据分析,下列说法中不正确的是( )| A. | X的分子式为C5H4 | |
| B. | 分子中氢原子的化学环境只有一种 | |
| C. | 1 mol X在一定条件下可与2 mol氢气发生反应 | |
| D. | X不能使高锰酸钾酸性溶液褪色 |
10.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n为正整数)( )
| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若HnXOm为强酸,则Y是活泼非金属元素 | |
| C. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| D. | 若X的最高正化合价为+5,则五种元素都是非金属元素 |
1.某同学利用图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.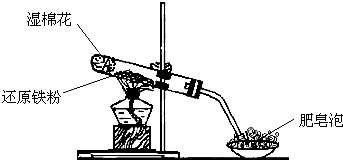
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)该同学欲确定硬质试管中固体物质的成分,设计了如下实验方案:待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液,试猜想该溶液中可能含有的金属阳离子.
猜想1:该溶液中可能含有Fe2+;
猜想2:该溶液中可能含有Fe3+;
猜想3:该溶液中可能含有Fe2+和Fe3+;
现在实验室有以下药品:NaOH溶液、KMnO4溶液、HNO3溶液、KSCN溶液、VC粉末并设计实验方案检验溶液中可能含有的Fe2+和Fe3+,请完成下表.

请回答下列问题:
(1)硬质试管中发生反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)该同学欲确定硬质试管中固体物质的成分,设计了如下实验方案:待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液,试猜想该溶液中可能含有的金属阳离子.
猜想1:该溶液中可能含有Fe2+;
猜想2:该溶液中可能含有Fe3+;
猜想3:该溶液中可能含有Fe2+和Fe3+;
现在实验室有以下药品:NaOH溶液、KMnO4溶液、HNO3溶液、KSCN溶液、VC粉末并设计实验方案检验溶液中可能含有的Fe2+和Fe3+,请完成下表.
| 实验操作 | 预期的现象与结论 |
| 步骤1:取1-2mL上述溶液于试管甲中,向里面再滴入几滴KSCN溶液,振荡 | 有溶液变血红色现象,则证明有Fe3+,若无该现象,则证明不含Fe3+. |
| 步骤2:另取1-2mL上述溶液于试管乙中,向里面再滴入几滴KMnO4溶液,振荡 | 有KMnO4溶液紫色褪去现象,则证明有Fe2+,若无该现象,则证明不含Fe2+. |
| 步骤3:综合步骤1.2 | 得出结论 |
 .
.
 ;
;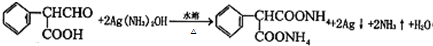 .
.
 ;
;  ;
;