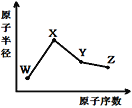
题目内容
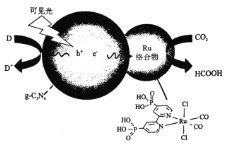
【题目】一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如图所示。
(1)基态碳原子的价电子排布图为_____________。
(2)1molHCOOH中含有的σ键数目为_____________,HCOOH的沸点比CO2高的原因为_____________。
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为_____________
(4)Ru络合物中与Ru配位的原子有N、_____________。
(5)Ru络合物含有的片段![]() 和
和![]() 中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是_____________(填“前者”或“后者”)。
中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是_____________(填“前者”或“后者”)。
(6)一种类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。

①g-C3N4中氮原子的杂化类型是_____________。
②根据图2,在图1中用平行四边形画出一个最小重复单元。_____________
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为____g.cm-3。
【答案】![]() 4NA HCOOH和CO2均为分子晶体,但HCOOH分子间存在氢键 N>O>C Cl、C 前者 sp2杂化
4NA HCOOH和CO2均为分子晶体,但HCOOH分子间存在氢键 N>O>C Cl、C 前者 sp2杂化 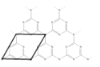
![]()
【解析】
(5)![]() 中N原子有一对孤电子,容易给出电子对形成配位键,
中N原子有一对孤电子,容易给出电子对形成配位键,![]() 中N原子参与形成大π键,不易给出电子对形成配位键。
中N原子参与形成大π键,不易给出电子对形成配位键。
(6)③由均摊法可知,该晶胞中N原子个数=8×![]() +8×
+8×![]() +2×
+2×![]() +4=8,C原子个数=3+6×
+4=8,C原子个数=3+6×![]() =6,
=6,
(1)C为6号元素,基态碳原子的价电子排布图为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)单键全是σ键,双键有一个是σ键,一个是π键,所以,1molHCOOH中含有4molσ键,即4NA,HCOOH和CO2均为分子晶体,但HCOOH分子间存在氢键,故HCOOH的沸点比CO2高,故答案为:4NA;HCOOH和CO2均为分子晶体,但HCOOH分子间存在氢键;
(3)Ru络合物中除Ru元素外还有H、C、N、O、P、Cl元素,位于第二周期的有: C、N、O三种元素,一般情况下,从左往右,第一电离能增大,但第ⅤA族的N原子2p轨道电子处于半充满状态,比O难失电子,第一电离能比O大,综上所述,三者第一电离能由大到小的顺序为:N>O>C,故答案为:N>O>C;
(4)由图可知,Ru络合物中与Ru配位的原子有N、Cl、C,故答案为:Cl、C;
(5)前者的sp2杂化轨道上有一个孤电子对,更容易形成配位键,故答案为:前者;
(6)①该物质中N原子价层电子对数为3,根据价层电子对互斥理论判断N原子杂化类型为sp2杂化,故答案为:sp2杂化;
②由图二可知,重复的结构单元为六元环和外加三个N原子形成的结构,如图所示: ,故答案为:
,故答案为: ;
;
③由均摊法可知,该晶胞中N原子个数=8×![]() +8×
+8×![]() +2×
+2×![]() +4=8,C原子个数=3+6×
+4=8,C原子个数=3+6×![]() =6,1个晶胞的质量=
=6,1个晶胞的质量=![]() ,密度ρ=
,密度ρ=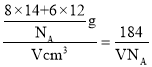 g.cm-3,故答案为:
g.cm-3,故答案为:![]() 。
。