题目内容
【题目】已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应:
①A+H2O―→B+C ②C + F―→D
③D+NaOH![]() F+E+H2O
F+E+H2O
(1)写出它们的化学式:
C________,D________,E________。
(2)写出各步反应的离子方程式:
①_______________________________________________________________;
③_______________________________________________________________。
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O。写出该步反应的化学方程式:____________________________________________________________。
【答案】 NO2 HNO3 NH4NO3 NH3 NH3+HNO3=NH4NO3 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
【解析】F是能使红色湿润石蕊试纸变蓝的气体,则F为NH3,由③D+NaOH→F+E+H2O,说明D是铵盐,E为钠盐,且A、B、C、D、E、F是含有同一种元素的化合物,则E是NaNO3,FC反应生成D冒白烟,反应生成的D是NH4NO3,根据②C+F→D,可知C是HNO3,再根据①A+H2O→B+C,则A是NO2,B是NO,则
(1)由上分析,A为NO2,C为HNO3,D为NH4NO3,F为NH3;(2)反应②的化学方程式为:NH3+HNO3=NH4NO3;(3)NH3经催化氧化生成NO和H2O,反应方程式为4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】(18分)绿矾(FeSO47H2O)是治疗缺铁性贫血药品的重要成分.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
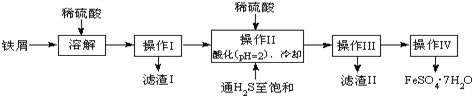
查询资料,得有关物质的数据如下:
25℃时 | pH值 | 25℃时 | pH值 |
饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(1)写出Fe和Fe2O3在硫酸溶液中发生反应的离子方程式为____、 ______ 、 __________;
(2)操作II中,通入硫化氢至饱和的目的是:①除去溶液中的Sn2+离子;②_________;③在溶液中用硫酸酸化至pH=2的目的是___________.
(3)操作IV的顺序依次为_____________、____________、过滤洗涤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②___________.
(5)常温下,Ksp[Fe(OH)2]=1.64×10-14,则求得反应:Fe2++2H2O![]() Fe(OH)2+2H+的平衡常数为:_______________(保留1位小数);
Fe(OH)2+2H+的平衡常数为:_______________(保留1位小数);
【题目】一定温度下,向3个初始体积均为1.0 L的密闭容器中按下表所示投料,发生反应N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡,下列说法错误的是
2NH3(g) △H<0达到平衡,下列说法错误的是
容器编号 | 容器类型 | 起始物质的量/mol | 反应物的转化率 | 平衡时NH3的物质的量/mol | ||
N2 | H2 | NH3 | ||||
Ⅰ | 恒温恒容 | 1 | 3 | 0 | α1 | 1.2 |
Ⅱ | 绝热恒容 | 1 | 3 | 0 | α2 | a |
Ⅲ | 恒温恒压 | 2 | 6 | 0 | α3 | b |
A. 达到平衡时,α1>α2
B. 平衡时NH3的物质的量b<2.4
C. 达到平衡时,容器Ⅱ中的反应速率比容器Ⅰ中的大
D. 保持温度不变,向容器Ⅰ中再充入0.1mol N2、0.2mol H2、0.2 mol NH3,平衡向正反应方向移动