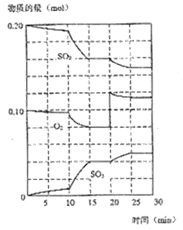
题目内容
【题目】乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
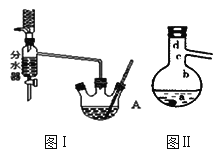
Ⅰ.将混合液(18.5 mL正丁醇和13.4 mL过量乙酸,0.4 mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟。
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤。
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1 g乙酸正丁酯。
部分实验数据如下表所示:
化合物 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 溶解度(g)/(100 g水) |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
乙酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(1)使用分水器(实验中可分离出水)能提高酯的产率,其原因是_______________.
(2)步骤Ⅱ中的操作顺序为____________(填序号),试剂X不能选用下列物质中的______________(填字母序号)。
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示)。
①当仪器连接好后,a.向相应的冷凝管中通冷凝水;b.加热蒸馏烧瓶,先后顺序是___________。(填“先a后b”或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的________(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质。
(4)该实验乙酸正丁酯的产率是_____________。(计算结果保留2位有效数字)。
【答案】 不断分离出水,有利于平衡向酯化反应方向移动 ①③①② b 先a后b a、b 74%
【解析】(1)由装置图可知仪器A将水分离出来,使产物中水的浓度减小,有利于酯化反应向右进行,所以使用分水器(实验中可分离出水)能提高酯的产率,故答案为:不断分离出水,使容器内H2O浓度变小,有利于平衡向酯化反应方向移动;
(2)首先用水除去大部分可溶于水的硫酸等杂质,再用Na2C03溶液除去残留的酸,再用水除去残留在产品中的Na2C03溶液,残留的水再用于燥剂除去,所以步骤Ⅱ中的操作顺序为①③①②;因Ca0吸水后生成碱会导致酯水解,故不宜用Ca0作干燥剂,所以选b;故答案为:①③①②; b;
(3)①为确保蒸馏产物全部液化,应先向冷凝管中通冷却水,然后加热烧瓶使温度迅速升温到沸点,所以先后顺序是先a后b;故答案为:先a后b;
②同一烧瓶中,反应液的温度高于气体温度,蒸气温度从下向上温度逐渐降低,故当温度计的水银球低于蒸馏烧瓶的支管口处时,会有较多沸点较低的物质夹杂在酯蒸气中,所以位于图Ⅱ中的a、b,故答案为:a、b;
(4)18.5mL正丁醇的质量是18.5mL×0.8g/mL=14.8g,设理论上得到乙酸正丁酯的质量是x,
CH3COOH+CH3CH2CH2CH2OH ![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
74 116
14.8g x
x=116g×14.8g÷74g=23.2g
生成乙酸正丁酯的产率是:17.1g÷23.2g×100%=74%,故答案为:74%。

【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:
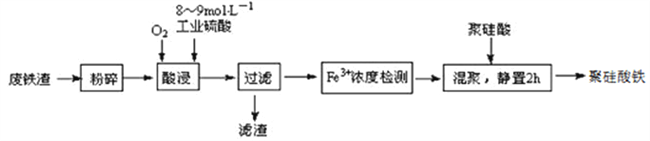
已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。