题目内容
【题目】某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子,若向其中加入Na2O2粉末,则充分反应后溶液中离子浓度保持不变的是(溶液体积变化忽略不计)
A. CO32- NO3- Na+ B. CO32- NO3- C. SO32- NO3- D. NO3-
【答案】D
【解析】
试题过氧化钠溶于水生成氢氧化钠和氧气,同时过氧化钠还具有强氧化性。则HCO3-转化为CO32-,SO32-被氧化为硫酸根离子,所以溶液中离子浓度保持不变的是NO3-,答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表前四周期的一部分,下列叙述正确的是( )

A. Y单质在空气中燃烧生成YO3
B. Z元素的最高价氧化物的水化物酸性最强
C. X的氢化物为H2X
D. Y、Z和W的阴离子半径依次增大
【题目】将氯气通入到水中所发生反应的化学方程式为______________________。已知生成物之一是一种弱酸,试写出该物质在水溶液中的电离方程式______________。某同学将有色布条浸泡在新制的氯水中,发现布条很快被漂白。对此他认为可能是因为氯水中含有某种粒子使布条褪色,于是他提出如下的假设,请你帮他设计实验方案以验证他的假设。
编号 | 假设原因 | 验证方案 |
1 | 可能是因为Cl2分子 | A:_____________ |
2 | 可能是因为H+ | B:_____________ |
3 | 可能是因为Cl- | C:_____________ |
4 | 可能是因为HClO | ———————————————— |
5 | 可能是因为ClO- | D:_____________ |
【题目】化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性良好)。请回答:
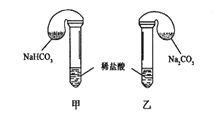
(1)各组反应开始时,____________(甲、乙)装置中的气球体积先变大,该装置中反应的化学反应方程式是_____________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,试分析原因并填写下表的空格。
试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
第①组 | 0.42gNaHCO3 0.53gNa2CO3 3mL 4mol·L-1盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V甲(CO2)= V乙(CO2) |
第②组 | 0.3gNaHCO3 0.3gNa2CO3 3mL 4 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | A:___________ |
第③组 | 0.6gNaHCO3 0.6gNa2CO3 3mL 2 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | B:______________ |
片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用化学方程式表示) C:___________ |
【题目】下列对分子中σ键重叠方式的分析不正确的是
A | B | C | D |
H2 | HCl | Cl2 | ClF |
两个氢原子的s轨道重叠 | 氢原子的s轨道和氯原子的p轨道重叠 | 一个氯原子的s轨道和另一个氯原子的p轨道重叠 | 氯原子的p轨道和氟原子的p轨道重叠 |
A. A B. B C. C D. D
