��Ŀ����
����β����NOx�����������������������㷺��ע��
��1��ij��ȤС����������������Ϣ��
N2(g)+O2(g)=2NO(g) ��H=+180.5kJ/mol
2H2(g)+O2(g)=2H2O(g)) ��H=�D483.6kJ/mol
��Ӧ2H2(g)+2NO(g)=2H2O(g)+N2(g) ��H= ��
��2����С�����õ��ԭ���������ͼ1װ�ý���H2��ԭNO��ʵ��[�����ӵ����Ե�SCY�մ�(�ܴ���H+)Ϊ���ʣ������ٱ�Ĥ���缫]��

�ٵ缫AΪ �����缫��ӦʽΪ ��
��3����������ԭNOԭ�����£�
����Ӧ��4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) (��H <0)
4N2(g)+6H2O(g) (��H <0)
����Ӧ��4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
4NH3(g)+ 4O2(g) 2N2O(g)+6H2O(g)
2N2O(g)+6H2O(g)
4NO(g)+4NH3(g)+3O2(g) 4N2O(g)+6H2O(g)
4N2O(g)+6H2O(g)
�й�ʵ�������ͼ2��ͼ3��ʾ���ݴ˻ش��������⣺

�ٴ���ԭNOӦ����n(NH3)/n(NO)�����ֵΪ �������� ��
������Ӧƽ�ⳣ������ʽ��K= �������¶ȵ����ӣ�K�� (ѡ����ӡ��� ����С�����䡱��
��Ӱ��N2O�����ʵ������� ������Ũ�Ⱥ� ��
��1��ij��ȤС����������������Ϣ��
N2(g)+O2(g)=2NO(g) ��H=+180.5kJ/mol
2H2(g)+O2(g)=2H2O(g)) ��H=�D483.6kJ/mol
��Ӧ2H2(g)+2NO(g)=2H2O(g)+N2(g) ��H= ��
��2����С�����õ��ԭ���������ͼ1װ�ý���H2��ԭNO��ʵ��[�����ӵ����Ե�SCY�մ�(�ܴ���H+)Ϊ���ʣ������ٱ�Ĥ���缫]��

�ٵ缫AΪ �����缫��ӦʽΪ ��
��3����������ԭNOԭ�����£�
����Ӧ��4NO(g)+4NH3(g)+O2(g)
 4N2(g)+6H2O(g) (��H <0)
4N2(g)+6H2O(g) (��H <0)����Ӧ��4NH3(g)+3O2(g)
 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)4NH3(g)+ 4O2(g)
 2N2O(g)+6H2O(g)
2N2O(g)+6H2O(g)4NO(g)+4NH3(g)+3O2(g)
 4N2O(g)+6H2O(g)
4N2O(g)+6H2O(g)�й�ʵ�������ͼ2��ͼ3��ʾ���ݴ˻ش��������⣺

�ٴ���ԭNOӦ����n(NH3)/n(NO)�����ֵΪ �������� ��
������Ӧƽ�ⳣ������ʽ��K= �������¶ȵ����ӣ�K�� (ѡ����ӡ��� ����С�����䡱��
��Ӱ��N2O�����ʵ������� ������Ũ�Ⱥ� ��
��1���D664.1kJ/mol (2��)
��2������(2��) 2NO+4H++4e��=N2��+2H2O (2��)
��3����1 (1��) n(NH3)/n(NO)С��1ʱ��NO�ѳ��ʲ��ߣ�n(NH3)/n(NO)����1ʱ��NO�ѳ������Ӳ�������N2O�������������ӣ� 3�֣�
��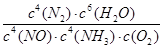 (2��) ��С(2��)
(2��) ��С(2��)
���¶�(1��) n(NH3)/n(NO) (1��)(�������մ�˳��ɵߵ�)
��2������(2��) 2NO+4H++4e��=N2��+2H2O (2��)
��3����1 (1��) n(NH3)/n(NO)С��1ʱ��NO�ѳ��ʲ��ߣ�n(NH3)/n(NO)����1ʱ��NO�ѳ������Ӳ�������N2O�������������ӣ� 3�֣�
��
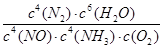 (2��) ��С(2��)
(2��) ��С(2��)���¶�(1��) n(NH3)/n(NO) (1��)(�������մ�˳��ɵߵ�)
�����������1�����ݸ�˹���ɣ�����2����Ӧ��ȥ��1����Ӧ�ɵã���H=�D664.1kJ/mol����2����ԭ���ԭ����֪���ڵ�·��������������������ͼ��֪���ٵ缫AΪ�������ٵ缫BΪ�������ɵ��ӡ���ɡ�ԭ�Ӿ��غ��֪�����Ի��������������Ļ�ԭ��ӦʽΪ2NO+4H++4e��=N2��+2H2O����3���ٶ�ͼ���Աȿ�֪��n(NH3)/n(NO)С��1ʱ��NO�ѳ��ʲ��ߣ�n(NH3)/n(NO)����1ʱ��NO�ѳ������Ӳ�������N2O�������������ӣ����n(NH3)/n(NO)�����ֵΪ1�����ɷ�Ӧʽ��֪��K=
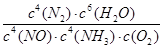 �����ڡ�H<0������Ӧ���ȣ�����ƽ�����ƣ�K��С�����������Ϣ��֪��Ӱ��N2O�����ʵ��������¶ȡ�n(NH3)/n(NO) ������Ũ�ȡ�
�����ڡ�H<0������Ӧ���ȣ�����ƽ�����ƣ�K��С�����������Ϣ��֪��Ӱ��N2O�����ʵ��������¶ȡ�n(NH3)/n(NO) ������Ũ�ȡ�
��ϰ��ϵ�д�
�����Ŀ
 O2��g��=CO2��g���� ��H2��b kJ��mol��1
O2��g��=CO2��g���� ��H2��b kJ��mol��1 2NH3��g������H����92.4 kJ��mol��1����ʼ���ǽ�N2��H2�������20 mol�������1��1������5 L�ϳ����У���ӦǰѹǿΪP0����Ӧ������ѹǿ��P��ʾ����Ӧ������
2NH3��g������H����92.4 kJ��mol��1����ʼ���ǽ�N2��H2�������20 mol�������1��1������5 L�ϳ����У���ӦǰѹǿΪP0����Ӧ������ѹǿ��P��ʾ����Ӧ������ ��ʱ��t�Ĺ�ϵ��ͼ��ʾ��
��ʱ��t�Ĺ�ϵ��ͼ��ʾ��
 CH3OH(g) ��H 1=��90.7 kJ��mol-1
CH3OH(g) ��H 1=��90.7 kJ��mol-1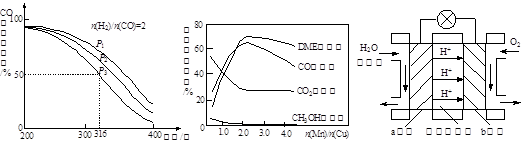

 SO3��g����NO��g��
SO3��g����NO��g��